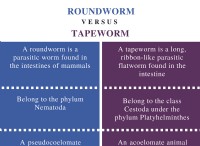
主な違い – マンガンとマグネシウム
化学元素は、原子核に同じ数の陽子を持つ原子を表す化学種です。これまでに発見されたすべての化学元素は、元素の周期表に配置されます。この元素の周期表は、原子核内の陽子数の昇順に従って化学元素を示しています。マンガンとマグネシウムはそのような化学元素です。マンガンの原子には 25 個の陽子があります。マグネシウムの原子には 12 個の陽子があります。マンガンとマグネシウムは、化学的および物理的特性が異なります。それらの発生も互いに異なります。ただし、マンガンとマグネシウムの主な違いは、マンガンの融点が約 1246 ℃ と非常に高い値であるのに対し、マグネシウムの融点は約 650 ℃ であり、マンガンよりも比較的低い値であることです。
対象となる主な分野
1.マンガンとは
– 定義、プロパティ、および反応
2.マグネシウムとは
– 定義、プロパティ、および反応
3.マンガンとマグネシウムの違いは何ですか
– 主な違いの比較
重要な用語:原子番号、電気陰性度、マグネシウム、マンガン、陽子
マンガンとは
マンガンは、記号 Mn で表される化学元素です。マンガンの原子番号は 25 です。したがって、マンガンはその核内に 25 個の陽子で構成されています。マンガンの原子量は約 54.93 amu です。マンガンの電子配置は [Ar]3d4s として与えられます。したがって、マンガンは周期表の d ブロックのグループ 7 に属します。マンガンはdブロック元素です。遷移金属と見なされます。

図 1:マンガンの原子構造
標準の温度と圧力条件では、マンガンは固相です。マンガンの融点は約1246℃です。これは非常に高い値です。マンガンは、化合物中にいくつかの酸化状態で存在できます。酸化状態は +7 から -3 まで変化します。マンガンの電気陰性度は 1.55 です。マンガンの原子半径は、d 軌道の存在により約 127 pm です。
マンガンは常磁性化合物と見なされます。これは、その軌道に不対電子が存在するためです。室温と圧力では、マンガンは非常に硬くてもろい金属です。さらに、マンガンにはいくつかの天然および合成同位体があります。しかし、Mn は 100% 安定で豊富な同位体ですが、他の同位体は微量しか見つかりません。
マンガンにはいくつかの異なる酸化状態があるため、さまざまな酸化状態のさまざまな種類の固体および液体化合物に含まれています。最も一般的な化合物の 1 つは KMnO4 です。 (過マンガン酸カリウム)。固体の場合は暗紫色をしており、水に溶けやすくMnO4を形成します。 イオン。この溶液も濃い紫色をしています。ここで、マンガン原子は +7 酸化状態にあり、これはマンガンが持つことができる最高の酸化状態です.

図 2:過マンガン酸カリウム固体化合物
マンガンは鉄鋼の製造に使用されます。鉄鋼生産におけるマンガンの役割は、脱酸および合金化剤として機能することです。さらに、マンガンはアルミニウム合金の製造に使用されます。それとは別に、マンガンは実験室規模のアプリケーションで必要とされる多くの化学種で有用です.
マグネシウムとは
マグネシウムは、記号 Mg を持つ化学元素です。それは、元素の周期表のグループ 2、期間 3 に配置されます。マグネシウムの原子番号は 12 です。つまり、マグネシウムの原子核には 12 個の陽子があります。室温および圧力条件では、マグネシウムは固相です。マグネシウムの電子配置は[Ne]3sです。したがって、0 および +2 の酸化状態を持つことができます。

図 3:マグネシウム結晶
マグネシウムの融点は約 650℃です。マグネシウムの原子質量は 24 amu として与えられます。周期表の s ブロックにあります。マグネシウムと同じグループの他の元素は、アルカリ土類金属と見なされます。これは、それらが形成する酸化物が基本的な特性を持っているためです。マグネシウムの電気陰性度は約1.31です。マグネシウムの原子半径は約 160 pm です。
マグネシウムには 3 つの安定同位体があります。最も多い同位体はMgです。その存在量は約 79% です。しかし、マグネシウムには放射性同位体も含まれています。マグネシウムは室温で水と反応します。この反応は水酸化マグネシウムを形成し、この反応中に水から水素ガスの泡が発生します。マグネシウムは多くの酸とも反応し、Mg イオンと水素ガスを形成します。マグネシウムは非常に燃えやすい。空気中で燃焼し、非常に光沢のある白い炎になります.

図 4:空気中のマグネシウムの燃焼
マグネシウムは主に鉱床に見られます。そのような鉱物はドロマイトとマグネサイトです。海水にもかなりの量のマグネシウムイオンが溶け込んでいます。マグネシウムは、特に航空機の設計や自動車の設計において、金属として幅広い用途があります。
マンガンとマグネシウムの違い
定義
マンガン: マンガンは、記号 Mn によって与えられる化学元素です。
マグネシウム: マグネシウムは、記号 Mg を持つ化学元素です。
原子番号
マンガン: マンガンの原子番号は 25 です。
マグネシウム: マグネシウムの原子番号は 12 です。
原子量
マンガン: マンガンの原子量は約 54 amu です。
マグネシウム: マグネシウムの原子量は約 24 amu です。
融点
マンガン: マンガンの融点は約1246℃です。
マグネシウム: マグネシウムの融点は約650℃です。
原子半径
マンガン: マンガンの原子半径は約 127 pm です。
マグネシウム: マグネシウムの原子半径は約 160 pm です。
周期表の位置
マンガン: マンガンは元素周期表の d ブロックにあります。
マグネシウム: マグネシウムは、元素の周期表の s ブロックにあります。
電子配置
マンガン: マンガンの電子配置は [Ar]3d4s
マグネシウム: マグネシウムの電子配置は [Ne]3s
電気陰性度
マンガン: マンガンの電気陰性度は約1.55
マグネシウム: マグネシウムの電気陰性度は約 1.31
酸化状態
マンガン: マンガンは、-3 から +7 までの酸化状態を持つことができます。
マグネシウム: マグネシウムは、0 および +2 の酸化状態を持つことができます。
結論
マンガンとマグネシウムは、地殻に豊富に存在する化学元素です。どちらも金属です。 2 つの名前は少し紛らわしいですが、非常に異なる物理的および化学的特性を示します。マンガンとマグネシウムの主な違いは、マンガンの融点が約 1246C と非常に高い値であるのに対し、マグネシウムの融点は約 650C であり、マンガンよりも比較的低い値であることです。