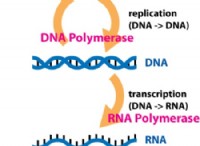
Stefan Thurner は生物学者ではなく、物理学者です。しかし、少し前に、オーストリアの国民健康保険クリアリングハウスは、ウィーン医科大学のトゥルナーと彼の同僚に、いくつかのデータを調査するよう依頼しました。結局のところ、データは匿名化された医療請求記録であり、約 800 万人を数える米国のほとんどで行われたすべての診断、すべての治療が行われたものでした。問題は、ギリシャで最近起こったように、資金の 3 分の 1 が蒸発した場合、同じ標準の治療を継続できるかどうかでした。しかし、Thurner は、データが同様に答えることができる他のより深い質問があると考えました。
New Journal of Physics の最近の論文で、Thurner と彼の同僚である Peter Klimek と Anna Chmiel は、人口全体における 1,055 の病気の有病率を調べることから始めました。彼らは統計分析を実行して、2 つの病気を併発するリスクを明らかにし、両方の病気にかかっている人の割合が、これらの病気が相関していない場合に予想されるよりも高い病気のペアを特定しました。平均的な人よりも他の人を持っている可能性が高くなります。彼らは統計的補正を適用して、非常にまれな疾患と非常に一般的な疾患との間の誤った関連性を引き出すリスクを減らしました。そのような分析では、診断の誤りが拡大されるからです。最後に、チームは結果をネットワークとして表示しました。このネットワークでは、病気が一緒に発生する傾向がある場合に、病気が互いに接続するノードです。
分析のスタイルにより、いくつかの予期しないリンクが明らかになりました。科学プレプリント サイト arxiv.org で公開された別の論文で、Thurner のチームは、糖尿病とパーキンソン病の間の論争の的となっている関係、および糖尿病患者が高血圧を発症するタイミングの独特なパターンを確認しました。 New Journal of Physics の論文は、さらに調査したいと考えている追加の関連性を生み出しました。
最終的に、Thurner をはじめとする多くの研究者は、これらの疾患ネットワークを使用して、疾患が分子レベルでどのように機能するかについて仮説を立てたいと考えています。 「この病気は遺伝子が原因ですか?」ターナーは言った。 「代謝ネットワークの欠陥が原因ですか?特定の遺伝子に影響を与える環境要因によるものですか?このようなもの。これが目的です。」
この研究は、医学で定義される病気は整頓された明確な存在のように聞こえますが、実際にはもっと厄介であるという認識によって推進されています。病気は症状によって定義される傾向があります。しかし、疾患の分子的根源には、現在の理解をはるかに超える生物学的影響がある可能性があります。特定の病気は、他の病気に続いたり、併存率が高い傾向があります。その理由は明らかではありませんが、関連する生物学的欠陥から生じる可能性があります.
ノースイースタン大学の物理学者で、2009 年のサーナーにインスピレーションを与えるのに役立った PlOS 計算生物学、および Nature Reviews Genetics の 2011 年の分野のレビュー。研究者は、疾患ネットワークを使用して、生物学者が、たとえば疾患 1 と 2 の間で共有される新しい疾患遺伝子、たとえば強い関連性があると思われる疾患遺伝子を探すことを提案するかもしれません。
生物学者は通常、遺伝マーカーを疾患と統計的に関連付けるゲノム全体の関連研究を使用して、遺伝的関連を探します。しかし、ハーバード大学医学部の別の研究チームは、非常に異なる種類のネットワークをマッピングすることによって、同じ接続を見つけようとしています:細胞内で働く分子ネットワークです.
生命のネットワーク
細胞の内部は、小さな分子、巨大なタンパク質、および DNA 鎖がお互いの周りを洗い流し、それぞれの仕事を行っているため、活発に活動しています。各アクターのビジネスは、他のアクターのセットです。たとえば、タンパク質は、他のタンパク質から断片を切り取ったり、分子を運んだり、DNA の製造を急いで開始したりする可能性があります。他のアクターから手がかりを得て、動作を速くしたり遅くしたり、必要な離れた地域に送信したりできます。
細胞の機能は、この分子社会的ネットワークのメンバーが 1 人でもおかしな振る舞いを始めると、まったく異なる特徴を帯びることがあります。やがて、その影響は最初の欠陥から波及し、有機体のレベルで問題 — 病気 — を引き起こします。病気は、ある意味では、この社会構造の根底にあるダイナミクスの表現にすぎません。 Thurner は、彼の疾患ネットワークが最終的にこれらの欠陥のいくつかを明らかにするのに役立つことを望んでいます.
そして、ハーバード大学医学部の教授であり、バラバシ氏の長年の共同研究者であるジョセフ・ロスカルゾ氏が、彼自身のネットワークをマッピングしているのは、ここが超顕微鏡的な限界です。彼と彼のチームは、タンパク質がどのように相互作用し、どのように相互作用するかについて、多数のデータベースからデータを収集することから始めます。次に、コンピューター モデルを使用して、平均的な細胞内の社会的ネットワークをスケッチし、個々の遺伝子とタンパク質がたまたま相互作用した場合に相互に接続します。 Loscalzo のチームは、13,460 のタンパク質ノードと 141,296 のリンクを含む図を作成しました。 (これらの相互作用はおそらく全体の約 20 ~ 25% に過ぎないと Loscalzo は言いますが、これは出発点です。) 次に、特定の疾患に統計的に関連しているノードだけを分離します。彼らはこのノードのセットを疾患モジュールと呼んでいます。
彼らが研究した疾患モジュールの 1 つは、肺高血圧症 (心不全を引き起こす可能性がある肺の高血圧) です。彼らは、ゲノム全体の関連研究が関与していることを示唆しているすべての分子経路を調べました。次に、動物モデルとストレス下の肺高血圧症患者で、どの経路がより活性化するかを研究しました。彼らの疾患モジュールは、以前はいくつかの形態の疾患に関連付けられていた 2 つのタンパク質が同じ分子経路の一部であり、それらが連携して細胞増殖のエラーを引き起こし、疾患の症状に関連している可能性があることを明らかにしました。研究者は、その調査結果を雑誌 Pulmonary Circulation に掲載しました。
別のモジュールでは、2 型糖尿病に注目します。研究者は、ゲノム全体の関連研究を通じて、糖尿病をゲノム上の約 200 のスポットに関連付けました。 「そのうちの最初の 18 程度は非常に重要ですが、最後の 182 程度はほんのわずかです」と Loscalzo 氏は述べています。しかし、疾患モジュールでは、これらの 182 の遺伝子の一部がソーシャル ネットワークで高度に接続されたハブであることが明らかになりました。これは、ゲノム全体の関連研究だけでは明らかにできない状況です。 「私たちは現在、それらの [遺伝子] のうち 3 つを調査しており、糖尿病に関連していると周辺的に信じられていたが、慎重な方法で実証されたことのない経路を強調しています」と彼は言いました.
Loscalzo の分子ネットワークを Thurner および Barabási の疾患ネットワークと組み合わせることは、相関関係とメカニズムの間の架け橋を作成するのに役立ちます。併存疾患が重複する分子ネットワークを共有している場合、研究者はネットワークを使用して、それらの背後にある生化学的メカニズムを理解できます。これら 2 種類のネットワークは、構築方法が大きく異なりますが、他の方法では見過ごされてしまう接続をデータが明らかにできるという考えによってのみ結合されます。しかし、これらのネットワークが一体となって、病気の研究に新たな扉を開く可能性があります.
「ネットワークを描くと、紙に仮説を描いていることになります」と Thurner 氏は言います。 「あなたは、『うわー、ほら、この2つが関連しているとは知らなかった』と言っています。なぜ彼らはできるのですか?ネットワーク分析では、まず、研究しているシステムで人々がすでに特定した接続が再作成されていることを確認して、分析を検証します。その後、サーナーは、「以前には存在しなかったもの、それらは新しい仮説です。その後、実際に作業が始まります。」
どちらの手法もまだ比較的新しいことを覚えておく価値があります。 Loscalzo 氏は、彼の結果に欠陥がある可能性を指摘することができます — タンパク質間相互作用に関するデータの広大な不完全性は大きな懸念事項ですが、データを収集するために使用される方法も同様であり、現在可能な限り最高ですが、完全にはほど遠いものです.また、サーナーと彼の学生たちは、仮説を検証できる生物学の共同研究者を今も集めています。数年前にデータベースから最初の結果を発表した後、Thurner 氏は皮肉を込めて言いました。これまでのところ、反応は少しずつです。
「それは議論の余地がないわけではありません」と、数理生物学のバックグラウンドを持つシカゴ大学の遺伝学教授であり、併存症ネットワークについて発表している Andrey Rzhetsky は述べた。 「一部の人々は、ビッグデータセットについて非常に強く感じています。大規模な分析からの結果を受け入れることを狂信的に拒否するほどです。」大規模なデータセットには未知のバイアスがあるというのが彼の主張です。 Thurner のようなデータベースの場合、これらのバイアスは、医師が医療記録に情報を入力するさまざまな方法や、民族性を説明する方法などに起因しています。 Rzhetsky は偏見の危険性を認めていますが、研究者が解釈に注意を払っていれば、データの有用性が失われることはないと考えています。 「それが将来の方向性だと思いますが、解決された問題にはほど遠いです」と彼は言いました。彼は New Journal of Physics の記事に興味をそそられました。 「モデルは非常にシンプルですが、方向性は素晴らしいです」と彼は電子メールに書いています.
Loscalzo は、同僚の精査を認識しています。 「私がネットワーク医療について話すとき、3 種類の反応がありました。スペクトルの一方の端にいるのは一般的に若い人たちです…彼らはこれは素晴らしいアイデアだと言います。私はこれまで考えたことがありませんでした。 …スペクトルの反対側には、私と同年代かそれ以上の人がいます。私はナショナル アカデミーのメンバーであり、それはすべて還元主義的な生物学に基づいています。私は自分の戦略を変えるつもりはありません.」そして、その中間には、健全な懐疑論を持ち、そこに行きたいと願う幅広い人々がいます.これらの概念が私たちに新しい洞察を与えることができるというある種の証拠になる.それが私たちが取り組んできたことです。」