2008 年の夏にメイン州で開催された会議で、生化学者の David Sabatini は、マサチューセッツ州ケンブリッジにある Whitehead Institute for Biomedical Research の彼の研究室から出てきた未発表の結果のプレビューで彼らを魅了する準備をして、仲間の聴衆の前に立ちました。プレゼンテーションはうまくいきませんでした。彼のグループは、彼と同僚が 10 年以上前に発見した細胞酵素である mTOR を研究していました。とりわけ、彼らは mTOR が細胞内のどこで凝集するかを見つけようとしました。これは、多様な細胞増殖プロセスに対する酵素の注目に値するが神秘的な影響を説明するのに役立つように思われたからです。サバティーニは誇らしげに、リソソームと呼ばれる細胞小器官の表面に沿って配列された酵素を示す、チームの調査結果をスライドに投影しました。
聴衆は半信半疑でした。 「人々は文字通り立ち上がって、『デビッド、あれは監房のゴミ箱だ』と言いました。意味がありません。なぜゴミ箱の外側を飾るのですか?」サバティーニは思い出した。
サバティーニの講演から 9 年が経ち、リソソームはより多くの尊敬を集めてきました。研究は、リソソームがゴミ箱の役割を超えて、遺伝子調節の仕事において核への重要なアドバイザーとして機能することを示し続けています.この地位の飛躍は、イタリアのバルガで 3 月 5 ~ 10 日に開催された第 4 回ライソゾーム病に関するゴードン研究会議で明らかでした。リソソームは、昨年 10 月に Annual Reviews of Cell and Developmental Biology に掲載された論文でも称賛されました。 、「規制ハブとしてのリソソーム」。その著者であるサンフランシスコ湾岸地域の研究者である Rushika Perera と Roberto Zoncu は、最近の研究が「リソソームの状態を異化の行き止まりから重要なシグナル伝達ノードにまで引き上げ、リソソームの論理を理解する上で広範囲に及ぶ影響を与えている」と述べています。健康と病気の両方における代謝調節。」
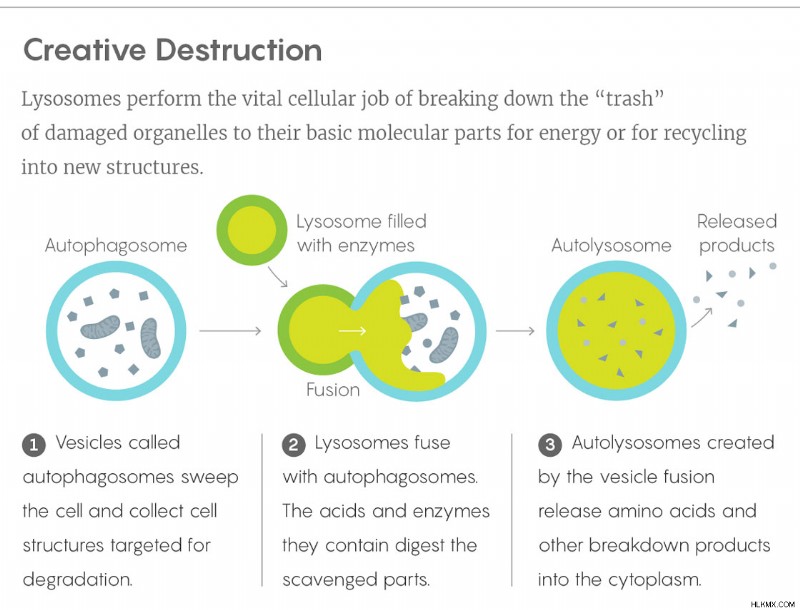
このリソソームのより高度な計算では、オルガネラは細胞全体からの代謝情報を巧みに統合し、それを核に伝達します。ルート上のすべての住宅所有者の秘密を知るガベージ コレクターを詮索するように、リソソームは、廃棄された分子を選別することによって、細胞の状態に関する独自の情報に基づいた視点を獲得します。そして核の精密に調整された遺伝的制御のいくつかは、それらがなければ無人になる可能性があります.
リソソームが最初に注目を集めたのは 1950 年代のことで、ベルギーの生化学者 Christian de Duve がラットの肝臓に見られるタンパク質を精製しようとしているときに、嚢状の細胞内構造に遭遇しました。彼は、これまで知られていなかった袋の名前をギリシャ語の「消化体」にちなんで名付けました。これは、その内容物が非常に酸性で、目の前にあるほぼすべての生体分子を分解する酵素で満たされているためです。 De Duve は 1974 年に彼の発見でノーベル賞を受賞しましたが、生物学者はオルガネラに熱心ではありませんでした。カリフォルニア大学バークレー校の生化学者である Zoncu は、研究者はリソソームに「細胞のごみ箱、またはゴミ箱 - 何も面白いことはない」というあだ名を付けました.
リソソームが重要ではないように見えたわけではありません — 廃棄物処理システムは必然的に重要です.それらは、細胞の損傷した、奇形の、余分な、またはそうでなければ望ましくないタンパク質やオルガネラを、過剰な糖や脂肪とともに消化する責任があります.遺伝的欠陥により、リソソームがそれらに関連する60以上の酵素のいずれかをほとんど作らなくなると、老廃物が細胞内に蓄積し、テイ・サックス、ニーマン・ピック、およびその他の障害などのリソソーム蓄積症を引き起こします.さらに、1990 年代に大隅良典 (最初は東京大学で、その後日本の基礎生物学研究所で) が率いる一連の実験で示されたように、リソソームはオートファジーの重要なプロセスにも関与しており、細胞がそれらを共食いすることを可能にします。必要なときに資源を得るために、また病気や老化の影響と戦うためにオルガネラを所有しています。この研究により、大隅は 2016 年にノーベル賞を受賞しました。これは、独房の低いゴミ箱に関する研究で 2 度目のノーベル賞を受賞したものです。
しかし、1980 年代、ナポリの Telethon Institute of Genetics and Medicine の創設者である Andrea Ballabio が生物学的研究を開始したとき、リソソームの研究は、その内部で何が起こっているかにほぼ専念していました。彼は、この分野が重度かつ狭義の疾患駆動型であったことを思い出します。ライソソームの研究者は、特定のライソソーム貯蔵障害で欠乏または機能不全に陥った酵素を精製しました。

バラビオは、特定の種類のリソソーム蓄積症を研究しているときに、リソソームに興味を持つようになりました。複数のスルファターゼ欠乏症は、うろこ状の皮膚、関節のこわばり、発作、発育遅延を引き起こします。この症状は、Ballabio のグループが発見したように、スルファターゼと呼ばれる酵素群の活性化に不可欠な遺伝子の突然変異から生じます。その多くはリソソームです。
バラビオのチームによるその発見は、まれなリソソーム障害の他の研究とともに、細胞にはリソソーム活性を高めるシステムと、細胞のゴミが積み重なるにつれてより多くのリソソームを作り始める方法が必要であるとバラビオに確信させました.これを行うには、「多くの異なる遺伝子の機能を制御する必要があります」と Ballabio 氏は述べています。彼は、これを行うマスター レギュレーターを探し始めました。
2009 年、彼のチームは重要なものを発見したと報告しました。彼らはそれを「転写因子EB」またはTFEBと呼んだ.細胞の核内で、TFEB は多くのリソソーム遺伝子の DNA 配列に結合し、それらがタンパク質を作る速度を制御します。
しかし、TFEB の活動がリソソームに対する細胞のニーズを包括的にどのように反映するのかは、まだ不明でした。しかし、少なくとも当初はリソソームとは何の関係もなかった研究から、すぐに答えが明らかになるでしょう。
合図の席
Roberto Zoncu が 2008 年にホワイトヘッド研究所のサバティーニの研究室にポスドクとして到着したとき、リソソームは彼の最優先事項ではありませんでした。研究室の焦点は、サバティーニが 1994 年に哺乳類細胞で発見し、ラパマイシンの機械的標的 (mTOR) と名付けられた酵素にありました (そして多くの点で今もそうです)。老化や、がんや糖尿病などの多くの病気に関与している mTOR は、驚くほどさまざまな状況下で細胞にシグナルを送り、細胞の成長と分裂を促します。 「私たちにとって大きな動機となる質問の 1 つは、それがどのように起こるかということでした。」サバティーニは言った。 「mTOR はどのようにして多くのことを感知し、それらの信号を統合して成長を促進するのでしょうか?」
チームが細胞内でのタンパク質の動きを追跡したとき、重要な手がかりが得られました。細胞をアミノ酸を含まない培地に浸した場合、mTOR は細胞質全体に均一に広がるように見えました。しかし、培地にアミノ酸が含まれていた場合、mTOR は数分以内に細胞内の特定の場所にある別個のクラスターに移動し、Rag GTPase と呼ばれる他のタンパク質によってそこに導かれました。 mTOR の酵素活性は、それらの場所に到達するかどうかに依存していましたが、mTOR をそこに誘導するタンパク質はそれをオンにしなかったようです。 「行き詰まりました」とサバティーニは言いました。
したがって、Zoncu は、mTOR タンパク質がアミノ酸に反応してどこに向かうのかについて、何が特別なのかを調べようと試みました。重要な実験で、彼は蛍光抗体のペアで細胞を染色しました。赤色のものは mTOR に結合し、緑色のものは実験の各ラウンドで異なる細胞小器官に関連するタンパク質に結合するように設計されています。次に、顕微鏡で細胞を調べ、緑と赤の蛍光タグが重なっている場所を探しました。これは、mTOR が集まった場所に他に何があったかを示します。
ミトコンドリア (代謝において非常に重要な潜在的標的) が染色されたスライドをスキャンしたところ、Zoncu は重複していないことを発見しました。彼は次のオルガネラのスライドに移りました。まだ重なりはありません。 「私はほとんど希望を失いました」と Zoncu は回想します。
次に、リソソームスライドが来ました。 「突然、すべてが完全に一致しました」と彼は言いました。赤の mTOR 染色とリソソーム マーカー LAMP2 の緑の染色は 100% 重複していました。
リサイクラーの活性化
これらの結果は、サバティーニが 2008 年のメイン会議で圧倒された聴衆に報告したデータをさらに裏付けるものです。しかし、Zoncu でさえ、懐疑論が正当化された可能性があることを認めています。彼によると、リソソームはまだ「着陸パッドにすぎなかった」可能性があり、活性化中に mTOR が着陸するのに便利な場所です.
しかしその後の実験では、そうではないことが示唆されました。 Zoncu が細胞からリソソームを抽出し、それらにアミノ酸をロードすると、リソソームが保持するアミノ酸が多いほど、mTOR が細胞表面に集まり、活性化することがわかりました。 (酵素 mTOR は細胞内で 2 つのタンパク質複合体を形成します。mTOR 複合体 1 [mTORC1] はリソソームに見られるものです。) 2011 年に発表されたこれらの実験は、mTORC1 がリソソームの内容物に応答することを示しています、とサバティーニは言います — リソソームが伝えるかのようにmTORC1 は保持するアミノ酸について、mTORC1 はそれに応じてその動作を調整します。
携帯電話の会話を広げる
バラビオの研究室とサバティーニの研究室が互いの結果を知り、力を合わせたとき、彼らはすぐに mTORC1 と TFEB のパズルのピースがどのように組み合わされるかを解明し、2012 年にその解決策を発表しました。タンパク質はアミノ酸成分に分解され、それらのアミノ酸はリソソーム表面のタンパク質と連携して mTORC1 を固定し、活性化します。次に、mTORC1 は細胞質の TFEB を核の外に保持します。細胞が飢えたりストレスを感じたりすると、mTORC1 がリソソームから離れ、TFEB が解放されて核 DNA 上の標的に結合します。リソソーム機能のマスター センサーとして機能する TFEB は、より多くのリソソーム酵素の遺伝子をオンにします。
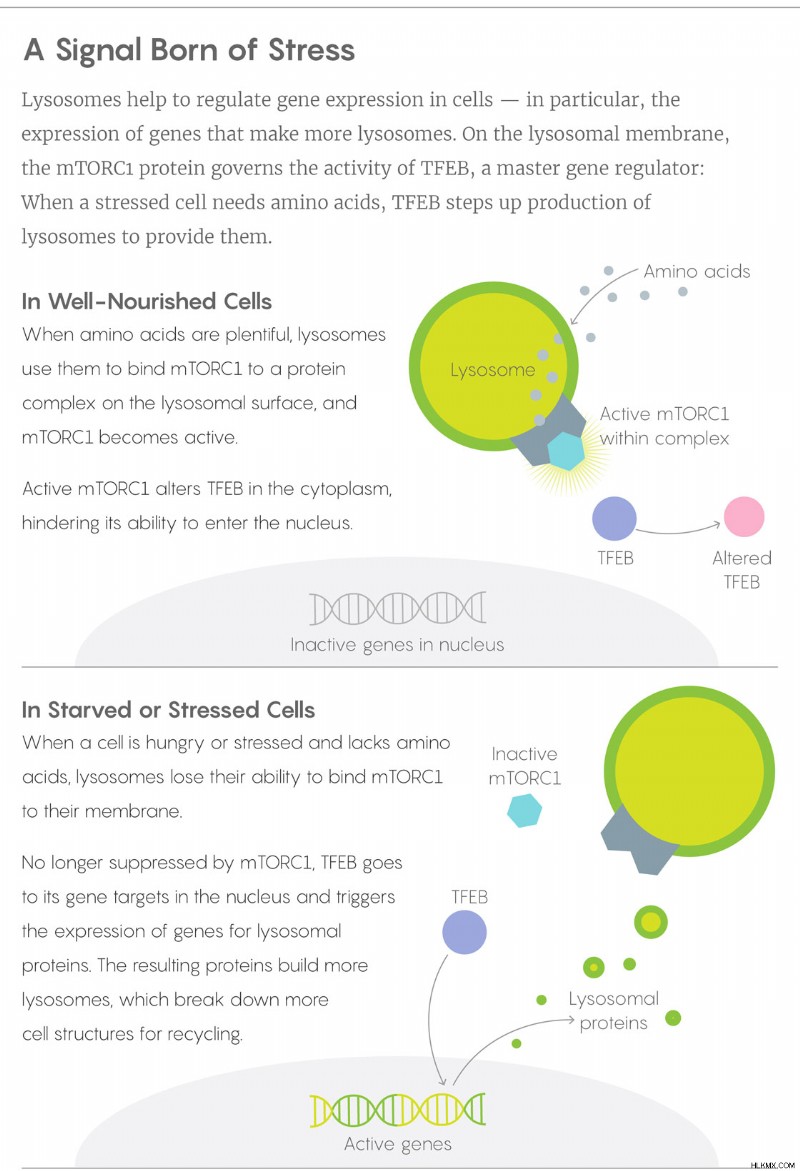
リソソームから TFEB を解き放つストレッサーは飢餓だけではありません。バラビオと彼の同僚は最近、TFEB が核に到達し、細胞が他のストレスの多いシナリオに対処するのを助けることができることを示した。 Ballabio 氏によると、いくつかのグループは、TFEB を遺伝子治療としてマウスに投与すると、ライソソーム蓄積症、食事誘発性肥満と糖尿病、およびアルツハイマー病とパーキンソン病に似た神経変性状態の症状を緩和できることを示しています。
3 月初旬、リソソームに関するゴードン会議の議長を務めていたとき、バラビオは電話で Quanta に振り返りました。 フィールドがどれほど劇的に変化したかについて。この分野はかつて圧倒的にリソソーム蓄積症に関するものでした。現在、病気の研究者は基礎研究を行っている人々と自由に交流している、と彼は言います。そして、リソソーム内の欠陥への焦点は、リソソーム膜と、細胞の残りの部分との会話でTFEB、mTOR、および約200の他の同定されたタンパク質を参加させる方法に移っていました.
癌は、リソソームのより良い理解につながる可能性のある頑固な状態の 1 つです。癌細胞は成長するために多くの栄養素を必要とするため、「多くの食物を取り込んで処理するために、胃 (リソソーム) を再プログラムまたは再配線する必要があります」と、カリフォルニア大学サンフランシスコ校の癌生物学者である Perera 氏は述べています。 /P>
彼女と Zoncu は、悪性細胞と正常細胞のリソソームの違いを共同で調査しています。さらに、彼らは、腫瘍細胞が使用するために栄養分を細胞質に逃がすリソソーム上の表面タンパク質を特定することに取り組んでいます.このようなタンパク質は、がん細胞がリソソームに収集する毒素や薬物を導入するポータルとして悪用される可能性があります。
もう 1 つの興味深い可能性は、ニューヨーク大学ランゴーン医療センターの神経科学者で、リソソーム会議でも講演した Ralph A. Nixon からもたらされました。彼の研究室や他の研究室での実験は、リソソームの機能不全を細胞の老化、寿命の短縮、およびさまざまな神経変性疾患に関連付けました。 2015 年、ニクソンと同僚は、アルツハイマー病に関連する特定の遺伝子変異が、リソソームの pH を維持するプロトン ポンプを無効にすることを示しました。リソソームから移動するイオンと代謝物のバランスを変える酸性度の変化は、細胞の代謝を損なう可能性があります。
ニューロンは、この種の低レベルのリソソーム破壊に対して独特に脆弱である可能性があり、それがなぜリソソーム障害が神経学的な結果をもたらすことが多いのかを説明できる可能性がある.将来の薬物介入により、リソソームのプロトン ポンプやその他のリソソーム機能の障害の問題が解決されれば、アルツハイマー病やその他の状態による神経変性の影響をある程度食い止めることができるかもしれません。オートファジーの速度を高めるか、リソソームの生成速度を高めるか、またはその両方によって、リソソーム機能を変更するいくつかの薬物化合物は、マウスの神経学的状態に対して有望であることが示された、と Nixon は言う.
リソソームは、かつては「見た目はつまらない」ゴミ箱のように見えたかもしれませんが、細胞の健康に不可欠な調節された信号プラットフォームとしてますます高く評価されています.そして、リソソームに対する見方が変わるにつれて、関連する生物学の見方も変わります。ペレラ氏は、癌研究者は長い間、悪性細胞を無停止で増殖させ増殖させる信号について、また細胞がどのように栄養素を吸収するかについてもっと知りたいと思っていたと述べています。彼女によると、リソソームの新しい見方は、これらが「同じ問題のすべての異なる側面」であることを明らかにしています。