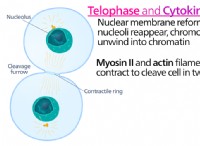
異なるアタッチメントサイト :S結合グリコシル化はシステイン残基で発生します。システイン残基は、セリンやスレオニンと比較してタンパク質では比較的まれなアミノ酸です。アタッチメントサイトのこの違いは、タンパク質の全体的な構造と機能を変える可能性があります。システイン残基はしばしばジスルフィド結合の形成に関与しており、セリンとスレオニンと比較して異なる化学的特性を持っています。
構造の違い :システインの硫黄原子は、糖部分とのチオエーテル結合を形成し、セリンまたはスレオニンのヒドロキシル基はエーテル結合を形成します。結合タイプのこの違いは、グリコシル化タンパク質の安定性、柔軟性、および立体構造特性の変動をもたらします。 S結合グリコシル化は通常、タンパク質のダイナミクスや相互作用に影響を与える可能性のあるO-グリコシル化と比較して、より剛性構造を生成します。
認識と結合 :天然のO-グリコシル化は、さまざまな生物学的プロセスに関与する特定のレクチンと酵素によって認識され、拘束されます。一方、S結合グリコシル化は、構造的な特徴が異なるため、これらのレクチンと酵素によって効率的に認識されない場合があります。これは、他の分子とのタンパク質とその全体的な生物学的機能に影響を与える可能性があります。
細胞機械 :S結合グリコシル化の原因となる細胞機構は、O-グリコシル化に関与するものとは異なります。さまざまな酵素と経路がグリコシル化の各タイプに利用されています。この違いは、グリコシル化の効率、特異性、および調節の変動につながり、全体的な細胞プロセスとタンパク質機能に影響を与える可能性があります。
機能的な違い :天然O-グリコシル化は、タンパク質の安定性、タンパク質間相互作用、細胞シグナル伝達、タンパク質分解分解からの保護など、タンパク質の多様な機能的役割を果たします。 S結合グリコシル化は、その異なる構造特性と相互作用のために、これらの機能を完全に再現しない場合があります。 S結合グリコシル化の特定の機能は依然として調査されており、タンパク質のコンテキストによって異なる場合があります。
要約すると、S結合グリコシル化はタンパク質に特定の構造修飾を提供できますが、付着部位、構造的特徴、認識と結合、細胞機械、および機能的役割の違いにより、自然なO-グリコシル化の役割を適切に模倣することはできません。