1。アクティブサイト:
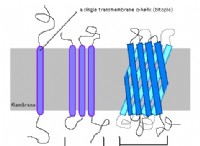
* 3D形状: 酵素には一意の3次元構造があり、アクティブサイトと呼ばれる特定のポケットを形成します。このサイトは、基質分子に対応するために正確に形作られています。
* アミノ酸残基: 活性部位には、さまざまな結合(水素結合、イオン結合、ファンデルワールス相互作用、疎水性相互作用)を介して基質と相互作用する特定のアミノ酸残基が含まれています。これらの相互作用は非常に特異的であり、その特定の基質を認識して結合する酵素の能力に寄与します。
2。ロックアンドキーモデルと誘導フィットモデル:
* lock-and-key: このモデルは、アクティブサイトをロックとして、および基板をキーとして想定しています。基板は、ロックにキーフィットするように、アクティブサイトに完全に収まります。このモデルは、特異性を決定する上で酵素の既存の形状の重要性を強調しています。
* 誘導フィット: このモデルは、ロックアンドキーモデルを改良します。アクティブサイトは柔軟であり、基質結合でその形状をわずかに調整できることを示唆しています。基質は酵素の立体構造の変化を誘導し、より正確なフィットと触媒の強化につながります。
3。酵素の柔軟性:
* 動的性質: 酵素は剛性構造ではありません。それらは、適切な基質結合と触媒作用に重要な微妙な立体構造の変化を起こすことができます。
* 立体構造の変更: これらの変化は、基質結合、pHの変化、またはその他の環境要因によって誘導される可能性があります。この柔軟性により、酵素はさまざまな基質と条件に適応できます。
例:
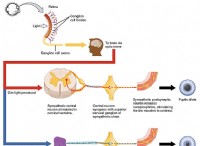
グルコースのリン酸化を触媒する酵素ヘキソキナーゼを考えてみましょう。ヘキソキナーゼには、グルコース分子を特異的に認識する活性部位があります。活性部位には、グルコースのヒドロキシル基と水素結合を形成するアミノ酸残基が含まれています。この特定の相互作用により、他の糖ではなくグルコースのみが酵素に結合してリン酸化を受けることが保証されます。
結論:
酵素の特定の3次元構造、特にその活性部位の形状と化学的性質は、特定の基質の特異性を決定します。この特異性は、細胞内の生化学反応の効率的かつ正確な調節に不可欠です。ロックアンドキーと誘導のフィットモデルは、酵素の構造と特定の基質を認識して結合する能力との相互作用を説明しています。