あなたの状態を変えるのはどれくらいクールですか?
私を凍らせてください。私は氷です。
私を加熱します。私は水です。
私を沸騰させてください。私はスチームです。
私にはさまざまな形と状態があります:私は物質です!
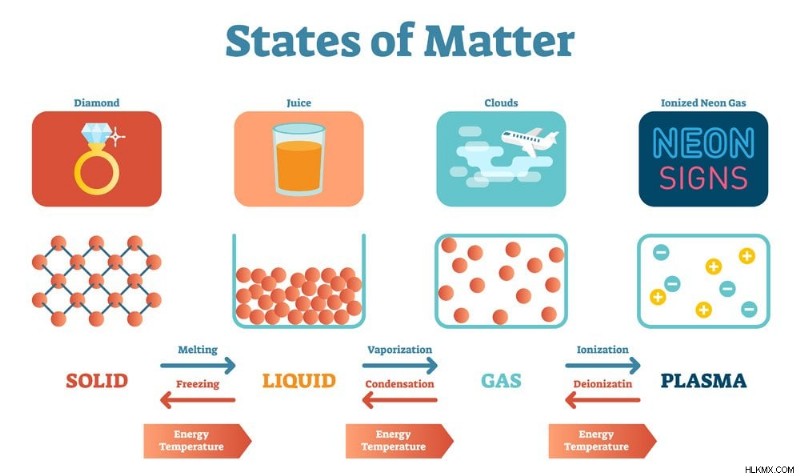
物質のさまざまな状態 (写真提供:VectorMine/Shutterstock)
「物質」 の多様性
簡単に言えば、物質の定義 質量を運び、空間を占有するものです。
物質には、固体、液体、気体、プラズマの 4 つの基本的な状態があります。
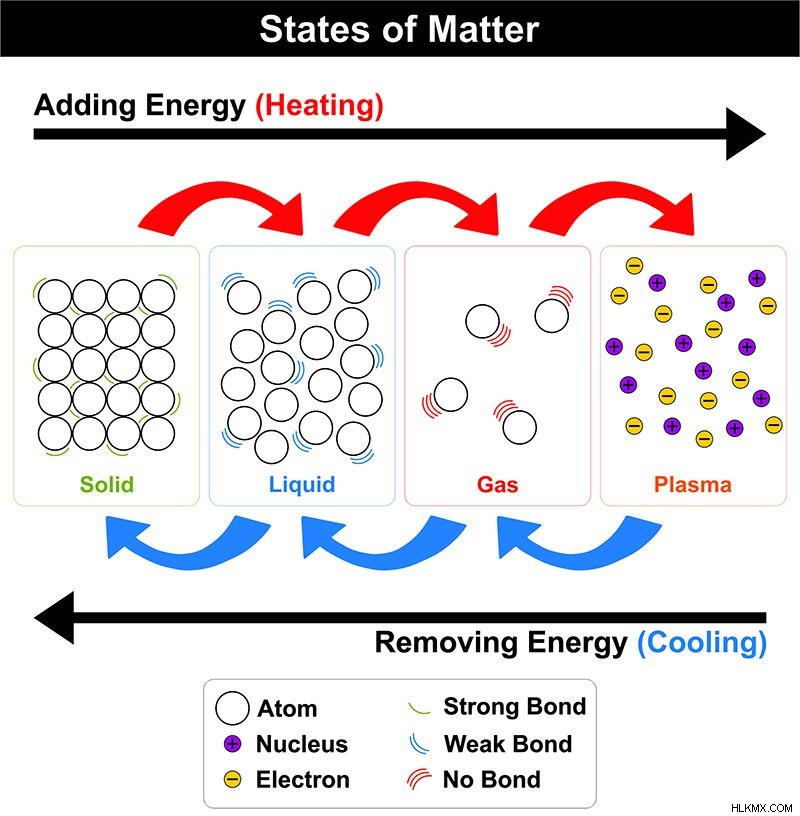
物質のさまざまな状態における分子の配置 (写真提供:udaix/Shutterstock)
ソリッド:
これらは硬くて非圧縮性で、明確な形状と体積を持っています。強力な分子間力により、分子間スペースがまったくないか、または無視できるほど分子が一緒に保持されます。固体中の分子は、運動エネルギーと振動エネルギーが低くなります。固体は、結晶または非晶質の 2 つの形態で存在できます。
固体炭素は、ダイヤモンドのような結晶形と木炭のような非晶質形で存在します。
液体:
これらは流動的で、一定の体積を持ち、一定の形状を持たず (容器の形状をとります)、非圧縮性です。中程度の分子間力により、弱い分子間スペースで分子が一緒に保持されます。液体中の分子は適度な運動エネルギーで動きます。液体は、毛細管現象、粘度、および表面張力の特性を持っています。
ガス:

気体の分子間空間 (写真提供:Arisa_J/Shutterstock)
これらは流動性も高く、不定の形状と体積を持ち、容易に圧縮できます。気体中の分子間力は非常に弱く、分子間距離は大きい。したがって、ガスは自由に流動し、ガス内の分子は高い運動エネルギーで動きます。
血漿:
宇宙で最も豊富な物質の状態は、プラズマまたは過熱物質です。 宇宙の物質の 99% はプラズマ状態です。 エネルギーが中性ガスを通過すると、電子が取り除かれ、正と負の両方に帯電したイオンが形成されます。形もボリュームもありません。プラズマは太陽と星を構成します。

(写真提供:Quardia/Shutterstock)
物質の状態を決定するものは何ですか?
物質は、与えられた温度と圧力で特定の状態をとります。その状態を制御する 2 つの要因は次のとおりです。
- 温度 (シャルルの法則で説明)
- 圧力 (ボイルズの法則で説明)
物質の状態に対する温度の影響を理解する
大気圧では、水は 0°C から 100°C の間の温度では液体として、100°C を超えると水蒸気 (気体) として、0°C 以下では氷 (固体) として存在します。物質が特定の状態で存在する温度範囲は、物質ごとに異なります。
水には 3 つの状態があることはわかっていますが、他の元素や化合物についてはどうでしょうか。鉄、酸素、塩化カルシウムは 3 つの状態で存在しますか?
強調された答えは、「すべての物質は、温度と圧力に応じて異なる状態で存在する」です。
上記から、酸素は> -182ᵒC で気体ですが、鉄は 2860ᵒC で気体です。すべての物質は 3 つの状態で存在できますが、各状態に到達する温度は大きく異なります。
シャルルの法則が物質の状態を支配する
シャルルの法則では、圧力が一定であれば、一定量のガスの体積はその絶対温度に正比例すると述べています。
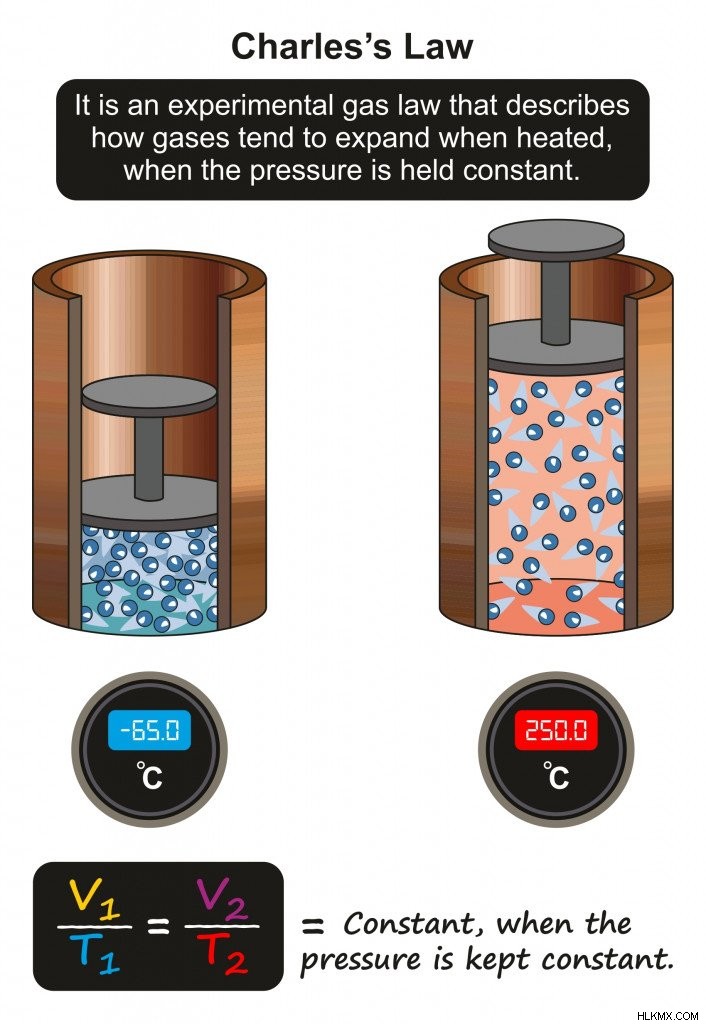
温度と体積の関係を仮定するシャルルの法則 (写真提供:udaix/Shutterstock)
圧力が一定の場合、固体 (つまり氷) の温度が上昇すると、その体積はそれに応じて増加します。体積が増加すると、分子は遠くに移動し、分子間距離が増加し、それによって分子間力が減少します。これが起こると、固体の氷は液体の水へとゆっくりと相転移します。
温度がさらに上昇すると、それに比例して体積が増加し、分子が互いに遠ざかります。これにより、分子間距離が長くなり、分子間引力が減少し、水 (液体) から蒸気 (気体) に移行します。
物質の状態に対する圧力の影響を理解する
前述したように、圧力は物質の状態を決定するもう 1 つの重要な要素です。この原理は、液体 N2 とドライアイス (固体二酸化炭素) の製造に使用されます。気体窒素は、気体の圧力が増加すると液体になります。
一方、圧力を十分に下げることで、室温で水を沸騰させることができます。
つまり、圧力と温度は反比例の関係にあります。液体 N2 とドライアイスは、ガス N2 と CO2 に圧力を加えて、それぞれ気体から液体、気体から固体に状態を変化させることによって製造されます。

Liquid N2 (写真提供:Suslov Denis/Shutterstock)

ドライアイス (写真提供:Kollawat Somsri/Shutterstock)
ボイルの法則が物質の状態を支配する
前述のように、圧力と温度の間には逆の関係があり、これはボイルの法則によって支配されます。法則によれば、一定の温度では、圧力が下がると気体の体積が増加します。
圧力と体積の関係を仮定するボイルの法則 (写真提供:udaix/Shutterstock)
上の図から、気体の圧力と体積は反比例することがわかります。
圧力が増加すると、体積が減少し、分子同士が接近します。これにより、分子間引力が増加し、分子間距離が減少します。これにより、気体から液体への移行が促進されます。
圧力がさらに上昇すると、体積がさらに減少し、液体が固体に変化します。
ドライアイスはどのように形成されますか?
ドライアイスの製造では、CO2 ガスの圧力を 1 気圧 (1 atm) から 5.11 に下げます。この圧力と一定の -56ᵒC では、気体の CO2 は非常に一時的な液体状態の固体の CO2 になります。
物質の 3 つの状態が平衡状態にある特定の温度と圧力は、三重点と呼ばれます。
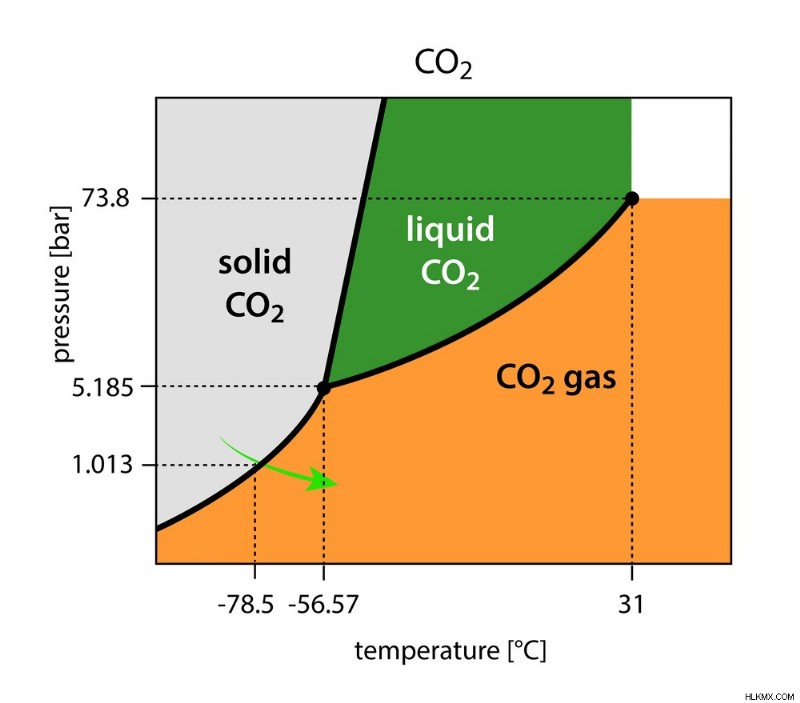
三重点:純粋な物質の固体、液体、気相が平衡状態で共存できる温度と圧力 (写真提供:マグネティックス/シャッターストック)
温度がわずかに下がると、気体の CO2 が固体の CO2 に相変化します。
結論
物質の状態は継続的にリサイクルされ、温度と圧力が相転移を制御します。すべての状態が共存する温度と圧力は、三重点と呼ばれます。 温度、体積、圧力の間で細かく調整されたプロセス あらゆる問題の状態を決定します。







