主な違い - リチウムと他のアルカリ金属
アルカリ金属という用語は、水素を除く周期表の第 1 族元素の名前として使用されます。したがって、アルカリ金属には、リチウム、ナトリウム、カリウム、ルビジウム、セシウム、フランシウムが含まれます。それらはいくつかの化学的および物理的特性を共有していますが、いくつかの異なる特性も持っています.これらの元素は、原子の最も外側の電子が ns 形式の s 軌道に存在するため、周期表のグループ 1 に含まれています。それらが形成する化合物は非常にアルカリ性であるため(塩基性化合物)、アルカリ金属として知られています。リチウムは、他のアルカリ金属の中で最小のアルカリ金属です。リチウムと他のアルカリ金属の主な違いは、リチウムは窒素と反応する唯一のアルカリ金属であるということです。
対象となる主な分野
1.リチウムとは
– 定義、化学的事実、独自の特性
2.アルカリ金属とは
– 定義、グループのメンバー、一般的なプロパティ
3.リチウムと他のアルカリ金属の違いは何ですか
– 主な相違点の比較
主な用語:アルカリ金属、アルカリ、陰イオン、塩基性、セシウム、陽イオン、フランシウム、リチウム、カリウム、放射性物質、ルビジウム、ナトリウム

リチウムとは
リチウムは、化学記号「Li」を持つアルカリ金属です。リチウムは、ビッグバンによってかなりの量が生成された唯一の 3 つの要素の 1 つと考えられており、他の 2 つの要素は水素とヘリウムです。以下は、リチウムの化学的事実です。
- 原子番号 – 3
- 原子量 – 6.941
- 電子配置 – [He] 2s
- ブロック – s ブロック
- グループ – 1
- ピリオド – 2
- 融点 – 180.50 °C
- 沸点 – 1330 °C
- 外観 – シルバーホワイト、メタリック
- 炎の色 – 真紅の色
- 共通同位体 – Li, Li

図 1:リチウムの炎の色は真紅です。
リチウムは非常に軽くて柔らかいため、ナイフで簡単に切ることができます。リチウムは水に浮くことができ、反応性が高いです。反応はしばしば爆発的であり、水酸化リチウムを生成します。ただし、リチウムは陰イオンを形成できない唯一のアルカリ金属です。しかし、リチウムは、その 3 つの電子のうちの 1 つを取り除くことによって、容易に陽イオン Li を形成します。
リチウムは他のアルカリ金属と似た性質を持っていますが、異なる独特の性質もあります。リチウム化合物は、アルカリ溶液を中和するために、他のアルカリ金属よりも多くの酸を必要とします。言い換えれば、リチウムは最も強いアルカリ溶液を形成します。リチウムは、窒素と反応できる唯一のアルカリ金属です。窒化リチウム塩が得られます。室温と圧力で、リチウム金属は次のように窒素ガスと反応します。
Li(s) + N2(g) → 2Li3 N(s)
リチウムは、アルカリ金属の中で最も密度が低いです。反応性が高いため、自然界には自由に存在しません。リチウム金属は空気にさらされると急速に酸化し、黒色の酸化被膜を形成します。
アルカリ金属とは
アルカリ金属は、水素を除く 1 族の元素です。したがって、このカテゴリのメンバーには、リチウム、ナトリウム、カリウム、ルビジウム、セシウム、およびフランシウムが含まれます。それらは、形成する化合物がアルカリ性 (塩基性化合物) であるため、アルカリ金属として知られています。
アルカリ金属は、s 軌道に最も外側の電子を持っています。したがって、それらは元素の周期表の s ブロックにあります。それらはns形式の最も外側の電子を持っています。したがって、それらは周期表のグループ 1 に属します。それらはすべて、最も安定した酸化状態として一価カチオンを形成します。
アルカリ金属のグループを下ると、次のような周期的な変動があります。
- 原子サイズが大きくなります。
- 強い結合を形成する能力が減少するため、融点と沸点が低下します (原子が大きくなると、形成される結合は弱くなります)。
- 密度が上がります。
- 最初のイオン化エネルギーが減少します。大きな原子では、最も外側の電子が緩く結合されており、簡単に除去できるためです。
- 電気陰性度が減少します。
- 反応性が低下します。
- アルカリ金属は、他の元素に比べて電子親和力が低いです。
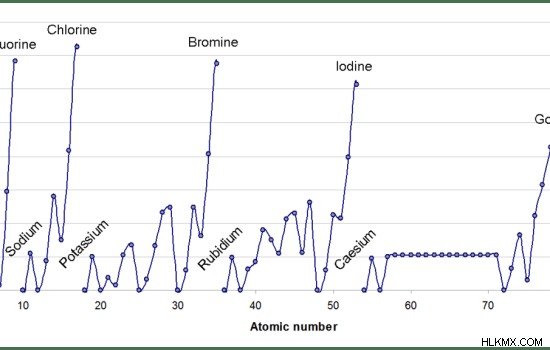
図 2:アルカリ金属は他の元素よりも電子親和力が低い
これらはプロパティのほんの一部です。ここで、このグループのメンバーに関するいくつかの事実を簡単に考えてみましょう.
リチウム
リチウムはアルカリ金属の中で最小の元素です。リチウムに関するその他の事実については、上記で説明しています。
ナトリウム
ナトリウムは、原子番号 11、化学記号「Na」を持つ化学元素です。ナトリウムの原子量は約 22.98 amu です。融点は 97.79 °C、沸点は 882.8 °C です。室温と圧力では、ナトリウムは固相です。金属光沢のある外観ですが、ナイフで簡単に切れる柔らかい金属です。
ナトリウムは反応性が高いです。酸素や水と反応しやすい。したがって、ナトリウムの金属形態は用途が少なくなります。柔らかすぎて反応性が高いため、建築資材としては使えません。燃焼すると、ナトリウムは黄橙色の炎を発します。少量のナトリウムを水に加えると、非常に爆発的な反応を示します。
カリウム
カリウムは、周期表の 1 族の下にある 3 番目のアルカリ金属です。カリウムは植物にとっても動物にとっても絶対に必要な元素です。 Humphry Davy 卿は、溶融水酸化カリウム (KOH) の電気分解によってカリウム元素を分離しました。カリウム金属は柔らかく銀白色です。それは非常に低い融点を持っています。金属なので電気の良導体です。カリウムは、地球上で 7 番目に豊富な元素です。市販されているほとんどの化合物は、カーナライトなどの特定の化合物の電気分解から得られます。これは、カリウム元素が水に不溶性の堆積物や岩石に存在し、抽出が困難なためです.
ルビジウム
ルビジウムは記号 Rb を持つ化学元素で、アルカリ金属です。銀白色の外観を持つ柔らかい金属です。反応性が高いです。わずかに放射性の同位体がいくつかあります。ルビジウム金属は容易に気化します。融点は 39.30 °C、沸点は 688 °C です。しかし、室温では固体です。
セシウム
セシウムは、化学記号 Cs を持つ化学元素です。セシウムの原子番号は55で、淡い金色の外観をしています。この金属の標準原子量は 132.9 amu です。室温で固相です。融点は 28.5 °C、沸点は 671 °C です。安定同位体は 1 つだけで、他の同位体は放射性です。
フランシウム
フランシウムは、記号 Fr と原子番号 87 を持つ化学元素です。2 番目に電気陰性度の低い化学元素です。天然に存在する最も希少な化学元素の 1 つです。フランシウムは非常に放射性があります.
リチウムと他のアルカリ金属の違い
定義
リチウム: リチウムは、化学記号「Li」を持つアルカリ金属です。
その他のアルカリ金属: アルカリ金属は、水素を除く 1 族の元素です。
窒素との反応
リチウム: リチウムは窒素ガスと反応できる唯一のアルカリ金属であり、窒化リチウムを形成します。
その他のアルカリ金属: リチウム以外のアルカリ金属は窒素ガスと反応しません。
原子サイズ
リチウム: リチウムはアルカリ金属の中で最小です。
その他のアルカリ金属: アルカリ金属の原子サイズはグループの下に向かって大きくなります。
原子番号
リチウム: リチウムの原子番号は 3 で、アルカリ金属の中で最も小さい値です。
その他のアルカリ金属: アルカリ金属には異なる原子番号があり、最小は 3 (リチウム) で、最大は 87 (フランシウム) です。
密度
リチウム: リチウムは固体金属の中で最も密度が低い.
その他のアルカリ金属: アルカリ金属の密度は、グループの下に向かって増加します。
陰イオン形成
リチウム: リチウムは陰イオンを形成できない唯一のアルカリ金属です。
その他のアルカリ金属: 他のアルカリ金属は、固相または液相で陰イオンを形成する場合があります。
塩基性
リチウム: リチウムは、リチウム含有溶液を中和するために、より多くの酸を必要とする最強の塩基性アルカリ金属です。
その他のアルカリ金属: アルカリ金属は異なる塩基性を持っています。
結論
アルカリ金属は、基本的な性質を持つ化合物を形成する化学元素です。このグループのメンバーには、リチウム、ナトリウム、カリウム、ルビジウム、セシウム、およびフランシウムが含まれます。リチウムと他のアルカリ金属の主な違いは、リチウムが窒素と反応する唯一のアルカリ金属であることです.
参照:
1. パパス、ステファニー。 「リチウムについての事実。」
2. LiveScience、Purch、2015 年 9 月 23 日、こちらから入手可能。染料、ジェームズ・L.「リチウム」。ブリタニカ百科事典、ブリタニカ百科事典、2018 年 1 月 3 日、こちらから入手可能。
3. 「アルカリ金属」ウィキペディア、ウィキメディア財団、2018 年 1 月 5 日、こちらから入手可能。
画像提供:
1. 「リチウム燃焼試験」ケミカルインタレスト – コモンズ ウィキメディア経由の自作 (パブリック ドメイン)
2. 「要素の電子親和性」Sandbh 著 – Commons Wikimedia による自身の作品 (CC BY-SA 3.0)