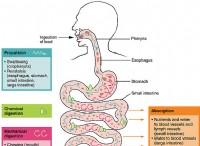
その理由は次のとおりです。
* エントロピー: システムの障害またはランダム性の尺度。
* 自発反応: エネルギーの外部入力なしで発生する反応。
* ギブス自由エネルギー(g): エンタルピー(H、エネルギーの尺度)とエントロピー(S)を組み合わせて、反応の自発性を予測する熱力学的ポテンシャル。方程式は次のとおりです。Δg=Δh -tΔS 、tは温度です。
キーポイント:
* 陽性エントロピー変化(ΔS> 0): 反応が障害を増加させると(より多くの製品、より多くのガス分子など)、エントロピーの変化は陽性です。
* 負のギブス自由エネルギーの変化(Δg<0): 自発的な反応は、負のギブス自由エネルギーの変化を抱えており、自由エネルギーを放出します。
* エントロピーと自発性の関係: 陽性エントロピーの変化は、負のギブス自由エネルギーの変化に寄与し、反応が自然発生する可能性が高くなります。
例:
*メタン(CH4)が二酸化炭素(CO2)と水(H2O)への燃焼は、エントロピーを増加させるため、自発的です。 反応物はメタンの単一分子であり、産物はCO2とH2Oの複数の分子を伴い、より大きな障害をもたらします。
重要な注意:
エントロピーの増加は自発性を支持しますが、それが唯一の要因ではありません。エンタルピー変化(ΔH)も役割を果たします。
* 発熱反応(ΔH<0): これらの反応は熱を放出し、自発的である可能性が高くなります。
* 吸熱反応(ΔH> 0): これらの反応は熱を吸収し、自発的である可能性が低くなります。
要約:
エントロピーを増加させる化学反応は自然発生する傾向がありますが、全体的な自発性はエントロピーとエンタルピーの変化のバランスによって決定されます。