1。開始点:
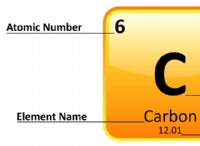
* ナトリウム(Na) 最も外側のシェルに1つの価電子があります。
* 塩素(cl) 最も外側のシェルに7つの価電子があります。
2。オクテットルール:
*原子は、電子を獲得、失い、または共有する傾向があり、8つの電子(貴族のような)の完全な外殻を実現します。これはOctetルールと呼ばれます。
3。 電子伝達:
* ナトリウム(Na) Noble Gas Neon(NE)のような安定したオクテット構成を実現するために、1つの価電子を失いたいと考えています。これにより、正に帯電したイオン(Na+)になります。
* 塩素(cl) Noble Gas Argon(AR)に似たオクテットを完成させるために1つの電子を獲得したいと考えています。これにより、負に帯電したイオン(CL-)になります。
4。イオン結合形成:
* Na+とcl-の反対の電荷は、互いを静電的に引き付け、イオン結合を形成します。
*結果の化合物であるNaClは、正と負の電荷のバランスのために中立電荷を持っています。
5。格子構造:
* NaClは個々の分子として存在しません。代わりに、静電力によって一緒に保持された繰り返しパターンでNa+およびCl-イオンが配置される結晶格子構造を形成します。
要約:
オクテットの規則は、ナトリウムと塩素が反応してNaClを形成する理由を説明するのに役立ちます。ナトリウムは安定したオクテットを達成するために電子を失い、塩素は電子を獲得して同じことを達成します。結果として生じる反対に帯電したイオンは互いに引き付けられ、イオン結合と安定した結晶格子構造を形成します。