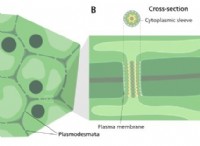
その理由は次のとおりです。
* 電子構成: マグネシウムの電子構成は2、8、2です。これは、その最も外側のシェルに2つの電子があり、価数シェルとも呼ばれることを意味します。
* 反応性: 原子は、安定した電子構成を達成する方法で反応する傾向があり、多くの場合、貴族に似ています。マグネシウムは、2つの原子価電子を備えた、これらの電子を容易に失い、ネオンのような安定した構成を実現します(2、8)。
* イオンの形成: マグネシウムが2つの原子価電子を失うと、正に帯電したイオン(mg²⁺)になります。この正電荷により、塩素(Cl⁻)などの負に帯電したイオンとイオン結合を形成して、塩化マグネシウム(MGCL₂)を形成することができます。
* 金属結合: マグネシウムは金属結合にも関与しており、そこではその原子価電子が非局在化され、結晶格子全体で共有されます。これにより、金属の電気と熱の伝導が可能になります。
要約、 マグネシウムの2つの価電子は、イオン結合、金属結合、および他の原子との電子の共有または伝達に関与しているため、化学反応の主要なプレーヤーです。





![[動画] 昼間に見た ISS とアトランティスのシャトル](/article/uploadfiles/202211/2022111014562385_S.jpg)