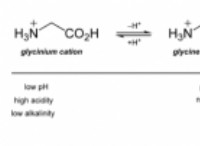
1。極性の違い:
* イオン化合物 強い静電力によって結合された荷電イオンで構成されています。陽イオンと陰イオンの間の電気陰性度の大きな違いにより、それらは非常に極性です。
* 有機溶媒 通常、非極性または弱い極性です。それらは、共有結合を持つ分子で構成され、原子間の電気陰性度の違いが小さくなります。
2。 「ように溶けるように」原則:
この原則は、極性物質が極性溶媒に溶解し、非極性物質が非極性溶媒に溶解することを示しています。 イオン化合物は非常に極性であり、有機溶媒は通常非極性であるため、互換性がなく、互いに容易に溶解しません。
3。溶媒和:
* イオン化合物 イオンを一緒に保持する強力な静電力を克服するために、極性溶媒分子との強力な相互作用が必要です。
* 有機溶媒 極性が弱いため、イオンの周りに強い溶媒和シェルを形成する能力がありません。
4。エネルギーの考慮事項:
*有機溶媒にイオン化合物を溶解するには、強力なイオン結合を破り、溶媒分子との新しい相互作用を形成する必要があります。
*このプロセスには、多くの場合、かなりの量のエネルギーが必要であり、イオンと有機溶媒分子の間の弱い相互作用によって容易に提供されません。
例外:
このルールにはいくつかの例外があります。
* 極有機溶媒: エタノールやメタノールのようないくつかの有機溶媒は、極性が高く、いくつかのイオン化合物を溶解することができます。
* 大きな有機イオンを含む塩: 大きな有機イオンを含む特定の塩は、有機イオンと溶媒分子の間に疎水性相互作用が存在するため、有機溶媒にいくらかの溶解度を示すことができます。
要約: イオン化合物と有機溶媒の非互換性は、極性の違い、「同様の溶解のような」原理、有機溶媒がイオンを効果的に溶解することができないこと、および溶解のための高エネルギー要件から生じます。