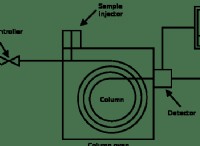
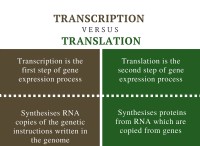
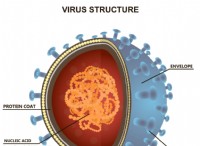
その理由は次のとおりです。
* 電子構成: 硫黄と酸素の両方に6つの価電子があります。酸素には電子構成1S²2S²2ppがあり、硫黄には構成1S²2pp⁶3S²3p⁴があります。 最も外側のシェル(酸素の場合は2番目、硫黄の場合は3番目)には6つの電子が含まれています。
* 化学挙動: 価電子の数は、元素が化学的にどのように相互作用するかを決定します。同じグループの元素は、同じ数の価電子を持っているため、同様の化学的性質を持つ傾向があります。酸素と硫黄はどちらも、外側のシェルに安定したオクテット(8電子)を実現するために、陰イオン(負に帯電したイオン)を形成する非常に反応性のない非金属です。
キーポイント:
*周期表は、原子数の増加に基づいて編成されています および定期的な傾向 電子構成と化学的挙動で。
*同じグループ(垂直列)の要素は、同じ数の価電子を共有するため、同様の化学的特性を持っています。
したがって、酸素と硫黄は異なる原子数と異なる電子シェルの数を持っていますが、それらの類似の価電子構成が周期表にグループ化される理由です。