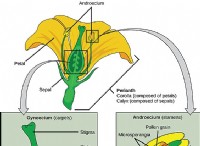
* ベリリウムの電子構成: ベリリウムの構成は1S²2S²です。 外側のシェルに2つの価電子があります。
* 塩素の電子構成: 塩素は、1S²2S²2P⁶3S²3P⁵の構成を持っています。外側のシェルに7つの価電子があり、もう1つは安定したオクテットを実現したいと考えています。
単純な転送が発生しない理由:
* 静電力: 塩素は電子を獲得したいと考えていますが、ベリリウムは簡単にあきらめたくありません。 ベリリウムの2つの原子価電子は、核によってしっかりと保持されています。 ベリリウムから電子を除去するには、多くのエネルギーが必要になります。
* イオン結合: 単純な移動はありませんが、ベリリウムと塩素はイオン結合を形成できます 。これは、ベリリウム *がその原子価電子の両方を失ったときに起こり、+2陽イオン(be²⁺)になります。 一方、塩素は電子を獲得して-1アニオン(cl⁻)になります。これらの反対に帯電したイオンは互いに引き付けられ、イオン化合物を形成します。
キーポイント:
* 電子移動: イオン結合内の電子を伝達するプロセスは、大幅なエネルギー変化とイオンの形成を伴うため、単純な「伝達」よりも複雑です。
* イオン化合物: Becl₂(塩化ベリリウム)は、このプロセスを通じて形成されたイオン化合物の例です。
ベクルまたはイオン結合の形成をより詳細に調査したい場合はお知らせください!