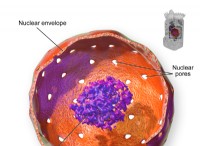
* 層: 有意に異なる電気陰性度を持つ原子が相互作用すると、イオン結合が形成されます。電気陰性度は、原子が電子を引き付ける能力です。
* 電子移動: 電気陰性度が高い原子は、電気陰性度が低い原子から1つ以上の電子を「盗む」ことができます。
* イオン形成: 電子を失う原子は正の帯電イオン(陽イオン)になり、電子を摂取する原子は負に帯電したイオン(アニオン)になります。
* 静電引力: これらの反対に帯電したイオンは、反対の電荷のために互いに引き付けられ、イオン結合が形成されます。
磁石のように考えてください:
*イオンの正と負の電荷は、磁石の反対側の極のようなものです。
*それらは自然に互いに引き寄せられ、イオンを硬い結晶構造で一緒に保持します。
簡単な例:
* ナトリウム(Na) 外側のシェルに1つの電子があり、積極的に帯電したイオン(Na+)になるように容易に失います。
* 塩素(cl) 外殻に7つの電子があり、容易に電子を獲得して負に帯電したイオン(CL-)になります。
* 塩化ナトリウム(NaCl) 、またはテーブル塩は、Na+とCl-の間のイオン結合によって形成されます。これらの反対に帯電したイオン間の魅力は、化合物を一緒に保持するものです。