一般的な傾向:
* 金属: 金属は を失う傾向があります カチオンを形成する電子 (積極的に帯電したイオン)。これは、それらが比較的少数の原子価電子(最も外側のシェルの電子)を持っているためであり、これらの電子を失い、安定した電子構成(貴族のような)を実現する方が簡単だからです。さらに左下にあるほど、要素が周期表にあるほど、陽イオンを形成する可能性が高くなります。
* 非金属: 非金属は gain になる傾向があります アニオンを形成する電子 (負に帯電したイオン)。それらは多くの価電子を持っており、電子を獲得して外側のシェルを完成させ、安定した構成を実現するのが簡単です。さらに、右に要素が周期表にあるほど、陰イオンを形成する可能性が高くなります。
* 遷移金属: 遷移金属は、異なる電荷で複数のイオンを形成できます。これは、電子構成の複雑さと、S軌道とD軌道の両方から電子を失う能力によるものです。
特定の例:
* グループ1(アルカリ金属): これらの要素は+1カチオンを容易に形成します。たとえば、ナトリウム(Na)はNa+を形成します。
* グループ2(アルカリアース金属): これらの要素は+2カチオンを容易に形成します。たとえば、カルシウム(CA)はCa2+を形成します。
* グループ17(ハロゲン): これらの要素は、容易に-1アニオンを形成します。たとえば、塩素(Cl)はCl-を形成します。
* グループ16(カルコジェン): これらの要素は通常、-2アニオンを形成します。たとえば、酸素(O)はO2-を形成します。
覚えておくべきキーポイント:
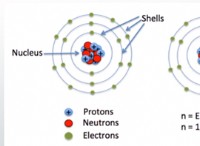
* 定期的な傾向: イオン化エネルギー(電子を除去するのに必要なエネルギー)は、期間を移動してグループを上に移動すると増加します。電子親和性(電子が追加されたときのエネルギー変化)も一般に、グループの上に増加します。これらの傾向は、元素が陽イオンまたは陰イオンを形成する傾向を説明するのに役立ちます。
* 例外: 一般的なルールには常に例外があります!たとえば、一部の元素は、それらがある化合物に応じて複数のイオンを形成できます。さらに、周期表の中央の要素は、金属と非金属の両方の特性を示す場合があります。
要約すると、周期表に要素を配置すると、陽イオンまたは陰イオンを形成する傾向の強力な指標が提供されます。一般的な傾向と特定の例を理解することにより、特定の要素によって形成されるイオンの可能性のある電荷を予測できます。