電子は、負電荷 e の基本単位を持つ亜原子粒子です。 .電子は、素粒子物理学の標準モデルで最も重要な粒子の 1 つであり、通常のバリオン物質の (陽子と中性子と共に) 3 つの主要構成要素の 1 つです。電子は、小さな部分や部分構造を持たないように見えるため、素粒子と見なされます。
最も正確に記録された電子の測定値は、0.000548579909067 amu の質量を示します 、これは 9.109382902843941771×10 kg に相当します .この量は、陽子の質量の約 1/1836 に相当します。そのため、電子は通常の亜原子粒子の中で群を抜いて最小の質量です。
電子は、物質の物理的および化学的挙動の大部分に直接関与しています。化学結合は電子の活動によって決定され、分子の形状は静電ポテンシャルによって決定され、色は電子による光の吸収によって決定され、物質の相挙動 (凍結、融解、昇華など) は分子間の静電相互作用によって決まります。電子 (陽子のような正に帯電した粒子と共に) は電磁気現象の原因です。
電子の性質
電子は素粒子と見なされます。つまり、適切な部分や部分構造はありません。各電子は約-1.602×10クーロンの電荷を持っています。電子が持つ電荷は負の電荷の可能な限り最小の単位であるため、その値はしばしば 基本単位 と呼ばれます。 担当。この電荷は、単一の陽子の電荷と正確に等しく反対です。
電荷に加えて、各電子にはスピンと呼ばれる性質があります .すべての電子は、1/2 の固有スピンを持っています。電子のスピンは、電子が生成する磁気モーメントの強さと、電磁界内で電子がどのように偏向されるかを決定します。スピンは、角運動量の古典的な性質に例えられることがあります。古典物理学では、荷電体が自身の軸を中心に回転すると磁場が生成されます。実際には、この類推は不適切です。電子は、自身の軸を中心に回転する小さな球体ではありません。それらは点粒子であり、連続値である古典的な体の角運動量とは異なり、電子スピンは常に離散量子化された値になります。代わりに、スピンは、量子領域に固有の電子固有の特性と見なされるべきです。
すべての粒子と同様に、電子は波のような性質を示します。電子は波動関数と呼ばれる数学関数で表すことができます (ψ) は、時間の経過に伴う電子の位置と運動量の進化を表します。波動関数を 2 乗すると、測定時に特定の位置で電子が見つかる可能性を示す確率密度が得られます。
原子中の電子

電子についての最も伝統的な理解は、原子におけるそれらの観察から来ています。電子は静電引力により、陽子と中性子を含む原子核に結合します。一般に、中性原子の場合、陽子と電子の量は同じです。通常の炭素原子には、6 つの陽子と 6 つの電子があります。陽子と電子の電荷が相殺され、原子全体が電気的に中性になります。原子は電子を受け取ったり失ったりしてイオンになります。電子を獲得すると、陰イオンと呼ばれる負に帯電したイオンが生成されます。電子を失うと、陽イオンと呼ばれる正に帯電したイオンが生成されます。
一般に、原子に結合した電子は、特定の事前定義された状態でのみ存在できます。これらの状態は原子軌道と呼ばれます。 軌道には、そこに存在する電子の性質を決定する定義済みの形状があります。最も重要なことは、各軌道には一定量の状態があり、2 つの電子が同時に同じ状態を占めることはできないということです。これは パウリの除外原則として知られています これは、2 つの電子が同じエネルギーで同時に同じ場所に存在することはできないことを示しています。 2 つの電子が同じ状態で存在する場合、+1/2 と -1/2 の反対のスピン数を持っている必要があります。
原子は、電子を除去して生成されたイオンを引き付けるか、電子を共有することによって化学結合を形成します。前者の方法で形成された化合物はイオン性と呼ばれ、後者の方法で形成された化合物は共有結合性と呼ばれます。

原子が電子を共有する場合、原子軌道を組み合わせて分子軌道を作成します。原子軌道が結合すると、分子軌道は 2 つの原子軌道を組み合わせた独特の形になります。池の波が干渉して新しい波のパターンを作成するのと同様に、電子軌道の定在波が結合して新しい安定した形状を作成します。
元素の結合挙動は、価電子と呼ばれる最も外側の電子によって決定されます。 ほとんどの元素は、8 個の電子の完全な外殻に達するまで化学結合を形成します。元素が外殻を 8 個の電子で満たす傾向は、オクテット規則と呼ばれます .オクテット規則は、電気陰性度を支配する規則と組み合わせて、ほとんどの主族化合物の組成を予測するために使用できます。
元素や化合物の化学結合挙動を決定することに加えて、電子はそれらの物理的特性の数も決定します。最も明白なのは、電子が物体に色を与える役割を果たしていることです。光が物体に当たると、光の光子が電子を励起し、電子をより高いエネルギー状態にします。電子が元のエネルギー レベルに戻ると、光子 (つまり光波) を放出します。観察者の目に反射する光は、オブジェクトがそうであるように見える色です。正確な電子配置によって、反射される光の波長が決まり、物体の色が決まります。
電子は、極性とファン デル ワールス力の形で、物質間の分子間相互作用も説明します。極性分子は、電子が不均一に分布しているため、部分電荷を持っています。分子間の極性相互作用は、凝固点、融点、沸点、比熱容量、熱力学的吸収率に影響します。
最後に、電子も分子構造を決定します。共有結合した化合物では、電子はそれらの間の電位を最小限に抑えるように広がります。その結果、化合物内で電子がどのように配置されているかがわかれば、その化合物の分子がどのような幾何学的形状を持っているかを予測できます。電子配置から幾何学的形状を予測することに焦点を当てた化学の分野は、VESPR 理論と呼ばれます。
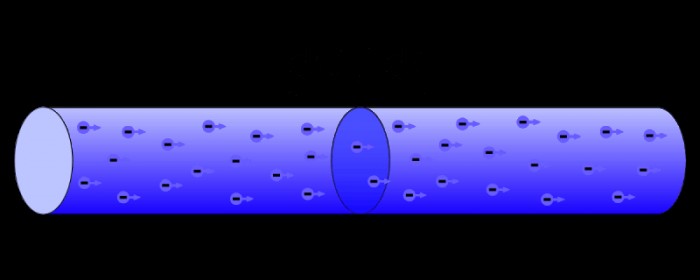
電子はまた、電気現象の主体でもあります。電流は、物質を通る負に帯電した電子の動きで構成されます。荷電粒子の動きは仕事を生み出すため、電気からのエネルギーを利用して物理的なタスクを達成できます。
電子の歴史
人類は、少なくとも古代ギリシャ時代から電気現象を知っていました。大プリニウスは、加熱された琥珀の破片がおがくずの小片を引き寄せ、鉄の破片をはじくことを実証しました。電気力の原因に関する高度な理論的理解が発達したのは、過去 300 年ほどのことです。
1700 年代、静電気を使った実験により、科学者は電気力はガラス質と樹脂質と呼ばれる 2 種類の相反する流体によって引き起こされ、摩擦によって分離され、互いに引き寄せられると考えるようになりました。ベンジャミン・フランクリンが、2 つの流体が実際には正の過剰 (+) または負の不足 (-) を持つ単一の流体であると示唆したのはこの頃であり、したがって現代の正電荷と負電荷の表記法が与えられました。
1800 年代に、科学者たちは、単位電荷を持つ亜原子粒子から構成された原子のイメージを受け入れ始めました。 1874 年、アイルランドの物理学者ジョージ ストーニーは、負電荷の基本単位を持つ粒子が存在することを理論化しました。彼は最初に「エレクトロライオン」、後に「電子」と名付けた理論上の粒子です。当時、ストーニーはそのような粒子の存在についての決定的な証拠を持っていませんでしたが、電気が物体間をどのように伝導するかに基づいてそれを仮定しました.
現在私たちが理解している電子は、英国の物理学者 J.J.トンプソンによって発見され、同定されました。 1897 年、トンプソンは、陰極線が、質量に対して非常に大きな電荷を持つ負に帯電した粒子で構成されていることを実証しました。トンプソンはもともと粒子を「小体」と呼びたかったが、他の科学者はストーニーが9年前に提案した「電子」という名前を好んだ. 1911 年、ロバート ミリカンは、単一電子の正確な電荷を正確に測定した有名な油滴実験の結果を発表しました。
1913 年、デンマークの物理学者ニールス ボーアは、電子が明確なエネルギー状態で原子の周りに存在することを理論化し、電子の最初の量子力学像を生み出しました。 1924 年、ルイ・ド・ブロイは博士論文を発表し、電子を含むすべての粒子が二重波動粒子の性質を持つという仮説を立てました。この認識により、1926 年に Erwin Schrödinger は、電子の波のような挙動を記述する数学関数である波動関数の数学的概念を開発しました。シュレディンガーの波動関数方程式に関するさらなる研究により、電子の反粒子である陽電子が発見されました。電子に関する現在の理解は、物理学者リチャード・ファインマンによって開拓された分野である現代の量子電気力学にカプセル化されています。