料金 アルミニウム イオンの 通常は 3+ です。これは、元素の原子番号が 13 であるためです。これは、13 個の電子と 13 個の陽子を持っているという事実を反映しています。アルミニウムの原子価殻には 3 つの電子があり、オクテット規則に従って、これらの 3 つの電子が失われ、10 個の電子と 13 個の陽子になります。アルミニウムには 3 つの余分な陽子があるため、基本アルミニウム イオンの電荷は 3+ です。
これが、アルミニウムの電荷が 3+ であることに関する簡単な答えです。しかし、イオン、イオン化、およびさまざまな元素の関係をよりよく理解するには、正イオンと負イオンの両方を詳しく調べる必要があります。
アルミニウムに関する事実
アルミニウムは、元素の周期表のホウ素グループの柔らかい金属です。記号「Al」で表され、原子番号13を持っています。アルミニウムは非常に豊富な元素であり、実際、地球の地殻で最も豊富な金属元素です。鉄とともに、アルミニウムは最も一般的に使用される金属です。 2016 年の世界のアルミニウム生産量は、約 5,900 万トンでした。アルミニウムは、車両、バッテリー、包装材料の作成、建物の建設、調理器具の作成など、さまざまな用途に使用されています。
原子の構造
原子は、2 つの異なる領域に分かれた 3 つの基本的な部分で構成されています。中性子、電子、および陽子は、原子の 3 つの構成要素です。陽子は正に帯電した亜原子粒子であり、中性子は電荷を持たない亜原子粒子です。中性子と陽子の質量はほぼ同じです。中性子の重さは約 1.67 x 10 グラムです。
原子の最初の領域は、原子の中心である原子核です。原子核は中性子と陽子で構成されています。原子核の外側は、原子核を周回する電子からなる軌道領域です。原子の最も外側の部分は、電子殻と呼ばれます。これらの電子殻は電子を軌道に保持し、原子は複数の電子殻を持つことができます。
原子は、単純な構成粒子がどのように配置されているかに基づいて、さまざまな特性を持っています。元素の原子番号は、その元素の原子が持つ陽子の数に基づいています。元素の原子が中性である場合、それは同じ数の電子と陽子を持っていることを意味します。元素が持つ中性子の数は、その元素の同位体を定義します。同位体は、原子が持つ中性子の数だけが異なる、素数元素の原子の単純な変形です。
まとめると、元素の質量数は、元素の原子内の陽子と中性子の数によって決まります。元素の同位体は、中性子の数が異なるため、わずかに異なる質量数を持っています。元素の原子質量は、元素のさまざまな同位体の質量数の平均を取ることによって識別されます。同位体は、原子核内の中性子の数が異なるために異なる元素の形態ですが、イオンは、元素の基本原子が 1 つ以上の電子を獲得または喪失したため、正味の電荷を持つ原子です。
イオンの定義
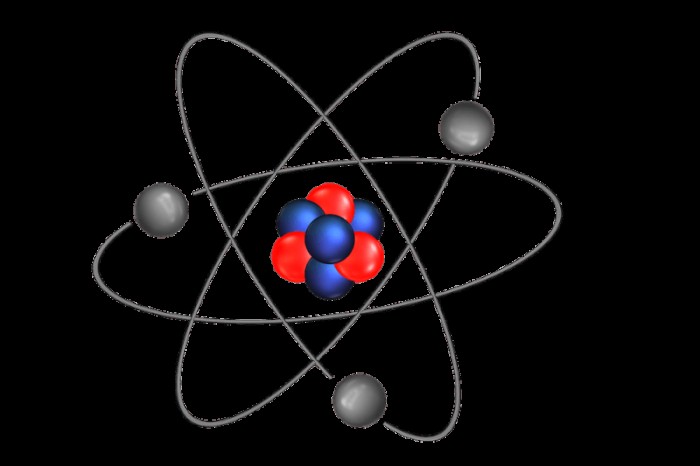
イオンは、原子価殻から 1 つまたは複数の電子を失った、または獲得した分子または原子であり、最終的に正味の負または正の電荷を与えます。別の言い方をすれば、イオンは化学種の電子と陽子の数が不均衡です。イオンという用語は、最初は英国の化学者マイケル・ファラデーによって、ある電極から別の電極に移動する化学物質を表すために造られました。
マイナスイオンとプラスイオン
純粋な原子には電荷がありません。これは、原子が同じ数の電子と陽子を持っているためです。電子は負の電荷を持っていますが、陽子は正の電荷を持つ亜原子粒子です。ただし、特定の状況や化学的相互作用により、原子が電子を放出したり、電子を獲得したりして、正味の電荷に影響を与える可能性があります。この場合、正味の電荷が影響を受ける原子はイオンになります。
例として、アルミニウム原子は 13 の陽子を持っているという事実を反映して、原子番号 13 を持っています。すべての陽子は正電荷を持っており、ほとんどの原子は中性であるため、13 個の電子と 13 個の陽子に対して電子があるということになります。これは、アルミニウムのすべての原子に当てはまります。金属は電子を失うことによってイオンを形成することができ、これは 3 つの電子を失うことができるアルミニウムにも当てはまります。
電荷の変化の結果として正イオンが生成される場合、そのイオンは陽イオンと呼ばれます。陽イオンは、それらを構成する元素によって示されるため、この例では、アルミニウム陽イオンがあります.
アルミニウムの特定の例では、13 個の電子と 13 個の陽子が 1 つを相殺するおかげで、アルミニウムの初期電荷はゼロでした。アルミニウム原子がイオンになると、電子を 3 個落とします。電子は 10 個しかないので、その値を陽子の数から差し引き、その差はプラス 3 になります。したがって、アルミニウムのイオンは、3+ として示される 3 の正電荷を持っています。一部の化学の本では、数字の後ろではなく数字の前に「+」記号が表示される場合があります。アルミニウムのカチオン バージョンは、プラス記号と上付きの数字 (Al または Al) で表示することもできます。
負に帯電したイオンに関しては、これらは陰イオンと呼ばれます。陰イオンは、全体的に負電荷を残す電荷変化の結果です。ご想像のとおり、陰イオンの表現には、陽イオンの正の符号ではなく、負の符号が付いています。例として、Cl- は、塩素が別の電子を拾うときに生成される塩素アニオンであり、正味の電荷は -1 になります。それぞれの元素の陽イオンと呼ばれる陽イオンとは異なり、陰イオンには特別な命名方式があります (そのため、塩素の陰イオンは塩素イオンとは呼ばれません)。
イオンが単一の元素から作られている場合、これは元素の名前に接尾辞「-ide」を追加することで示されるため、塩素アニオンは塩化物になり、炭素と窒素またはCN-のイオンはシアン化物になります.ほとんどの場合、「-ide」サフィックスで十分です。ただし、複数の元素からなるイオン (多原子陰イオンと呼ばれる) や、酸素を含む陰イオンがある場合は、さらに多くの接尾辞と接頭辞が必要です。接尾辞「-ate」は、典型的な数の酸素原子を内部に持つオキシアニオンに適用されます。一方、標準よりも酸素が 1 つ少ないオキシアニオンには、接尾辞「-ite」が適用されます。
通常よりも酸素が 2 つ少ないが、電荷が最小のオキシアニオンの場合、元素塩基は「-hypo」接頭辞と「-ite」接尾辞の中間に追加されます。一方、標準よりも酸素原子が 1 つ多くても通常の電荷を持っているオキシアニオンの場合、per-prefix と "-ate" 接尾辞が追加されます。最後に、酸素を硫黄で置換した陰イオンには、接頭辞「チオ-」が付けられます。
さまざまな元素がさまざまな方法でイオンを生成することができます。これは、元素の周期表にいくつの異なる族があるかを考えると驚くべきことではありません。ただし、これらの多くの元素は族にグループ化される可能性があるため (周期表で見つかったグループまたは列が与えられると)、これらの元素がイオンを作成する方法を予測できる可能性があります。いくつかのヒューリスティックを使用して、イオンの生成を予測できます。
一般に、周期表の第 1 族に含まれるアルカリ金属は、イオン化すると 1+ イオンを生成します。例として、Li+ はリチウムのイオンです。周期表の第 2 族に含まれるアルカリ土類金属は、イオン化して 2+ 陽イオンになります。ベリリウムは Be 2+ イオンを作ります。インジウム、ガリウム、アルミニウムなど、周期表の第 3 族に含まれるほとんどの金属は、イオン化して 3+ 陽イオンを形成します。上記のアルミニウムカチオンは、Al 3+ として定義されます。酸素、テルル、セレン、硫黄などの 6 族メタロイドおよび非金属は、イオン化すると 2- アニオンを生成します。たとえば、酸素の安定した電離状態は O2- として与えられます。周期表の第 7 族にある元素は、イオン化すると -1 の陰イオンを生成します。このため、フッ素の陰イオンは Fl- として与えられます。
純粋な金属、つまり非遷移金属は、常に陽イオンまたは陽イオンを形成します。実際、金属の決定的な特徴の 1 つは、金属が電子を放出する傾向があることです。対照的に、遷移金属または半金属は、さまざまな電荷強度を持つイオンを形成する可能性があり、これらの陽イオンが形成されるさまざまな方法を分類することは、純粋な金属よりも複雑です。
金属は通常陽イオンを形成しますが、非金属は通常電子を獲得して陰イオンを形成します。金属が電子を失うのと同様に、非金属の決定的な特性は、しばしば電子を獲得することです。これらの金属および非金属が電子を獲得または失う理由は、多くの複雑な要因と関係があります。元素のイオン化に影響を与える要因には、各原子が持つ価電子の数やオクテット規則の化学結合などがあります。