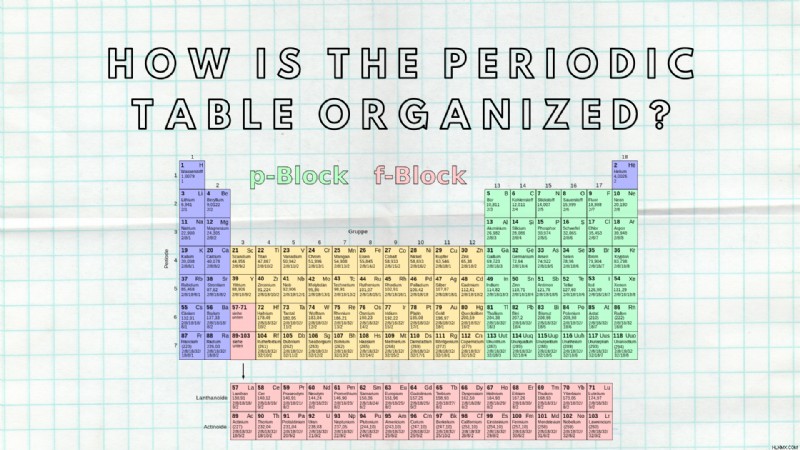
科学の学生が学ばなければならないことの 1 つは、周期表です。 周期表はどのように構成されていますか ?周期表はグリッドのように構成されています。
この記事では、グリッドが要素を整理する方法について説明します。元素がグリッド内でどのように編成されているかを理解することは、周期表を学ぶのに役立ちます。
各要素の位置はまったくランダムではなく、その原子構造によるものです。
グリッド構造
すべてのグリッド構造と同様に、周期表には上下の列と左から右の行の両方があります。行と列は、正確な特性によって編成されます。同じ列または同じ行にある要素には、共通の特性があります。たとえば、マグネシウム (Mg) とナトリウム (Na) は電子配置が似ているため、いくつかの性質を共有しています。元素の電子配置が似ている場合、それらは同じ周期にあると言われます。
しかし、それは行のみを説明しています。列は、類似した化学的性質を持つ元素のグループに編成されています。たとえば、カリウム (K) とルビジウム (Rb) は最初の行にあり、同じグループに属していることを意味します。
化学元素も、原子番号ごとに増加するように配置されています。
期間
周期を調べてみましょう。結局のところ、それが周期表の名前の由来です。左から右への各行はピリオドと呼ばれます。それが意味することは、行内のすべての元素が他の元素と同様の電子配置を共有しているということです。または、言い換えれば、同じ行の各要素には、まったく同じ数の原子軌道があります.
一番上の行のすべての元素、つまり第 1 周期の元素を見ると、すべての元素が電子に対して 1 つの原子軌道を持っていることがわかります。次に、2 番目の行、つまり 2 番目の周期の要素は、電子に 2 つの原子軌道があることによって特徴付けられます。 1 行おきまたは 1 周期ごとに、別の原子軌道を追加する必要があります。
特定の元素が持つ原子軌道の数がわかれば、それがどの行にあるかを知ることができるはずです。別の見方をすると、元素が周期表のどの行を占めているかがわかれば、特定の元素が持つ原子軌道の数 (1、2、3 など) がわかります。
グループ
では、グループを見てみましょう。同じ列 (上から下) のすべての化学元素は、同じグループに属します。実際、すべての列はグループと呼ばれます。しかし、要素はどのように「グループ化」されているのでしょうか?
各グループのすべての要素は、価電子とも呼ばれる外側の軌道に同じ数の電子を持っています。これらの電子は、他の元素との化学結合に関与しているため重要です。
グループは左から右に読む必要があります。最初の列またはグループ 1 のすべての要素には、1 つの価電子 (外殻に 1 つの電子) があります。 2 番目の列、つまりグループ 2 のすべての元素には、2 つの価電子があります。しかし、3 番目のグループ (グループ 3) のすべての要素には、13 個の価電子があります。それ以降は、18 に達するまですべてのグループに電子を追加する必要があります。列を数えるだけで、各要素の外殻にある電子の数を知ることができます。ただし、一部の元素は電子を追加する遷移元素であるため、これにはいくつかの例外があります。
8 つの異なるグループがあります:
- グループ 1 はアルカリ金属:リチウム (li)、ナトリウム (Na)、カリウム (K)、ルビジウム (Rb)、セシウム (Cs)、フランシウム (Fr) です。
- グループ 2 は、ベリリウム (Be)、マグネシウム (Mg)、カルシウム (Ca)、ストロンチウム (Sr)、バリウム (Ba)、およびラジウム (Ra) のアルカリ土類金属です。ラジウムは、その放射能のために地球上で常にアルカリ性とは考えられていません.
- 第 13 族はホウ素族です。ホウ素 (B)、アルミニウム (Al)、ガリウム (Ga)、インジウム (In)、タリウム (Tl)、および場合によってはウンウントリウム (Uut) です。
- グループ 14 は炭素グループです:炭素 (C) シリコン (Si)、ゲルマニウム (Ge)、スズ (Sn)、鉛 (Pb)、および場合によってはウンクオジウム (Uuq)。
- グループ 15 は窒素グループです:窒素 (N)、リン (P)、ヒ素 (As)、アンチモン (Sb)、ビスマス (Bi)m、および場合によってはウンウンペンチウム (UUp)。
- グループ 16 はカルコゲンであり、酸素グループとしても知られています:酸素 (O)、硫黄 (S)、セレン (Se)、テルル (Te)、ポロニウム (Po)、ウンウンヘキシウム (Uuh)。
- グループ 17 はハロゲン用です:フッ素 (F)、塩素 (Cl)、臭素 (Br)、ヨウ素 (I)、アスタチン (At)、および場合によってはウンウンセプチウム (Uus)。
- グループ 18 は、ヘリウム (He)、ネオン (Ne)、アルゴン (Ar)、クリプトン (Kr)、キセノン (Xe)、ラドン (Ra) の希ガスです。
これらの各グループには、より詳細に研究できる共通の特性がありますが、周期表がどのように構成されているかを確認するためにそれらを知る必要はありません.
トップの 2 つの要素
一番上にあるのは水素 (H) とヘリウム (He) だけです。これら 2 つは、さまざまな理由から特別な要素です。
水素 (H) は中性の形で中性子を 1 つも持たず、陽子を 1 つと電子を 1 つだけ持っています。現在、原子状水素は、その外殻を満たすために他の元素と結合する必要があります.
ヘリウム (He) は、すべての元素の中でユニークです。原子価殻とも呼ばれる外側の軌道には、2 つの電子しかありません。他のすべての希ガス (グループ 18) は、外側の軌道または原子価殻に 8 つの電子を持っています。では、なぜヘリウムはネオン (Ne)、アルゴン (Ar)、クリプトン (Kr)、キセノン (Xe)、ラドン (Ra) のグループなのでしょうか?それらには共通点が 1 つあります。それは、それぞれの原子価殻がいっぱいであることです。
これが周期表の構成です。それぞれの要素の位置を理解することは、それらのプロパティを理解するのに役立ちます。周期表を暗記しようとしている場合、または科学グループの一員として元素を研究する必要がある場合、元素の位置がランダムではなく、非常に厳密な論理に従っていることを知っていると、学問的努力に役立つ可能性があります.







