水の凝固点を知っていますか?凝固点は融点と同じですか.ここでは、凝固点の温度、それに影響を与える要因、およびそれが融点と同じかどうかを見ていきます.
通常の水の凝固点の温度
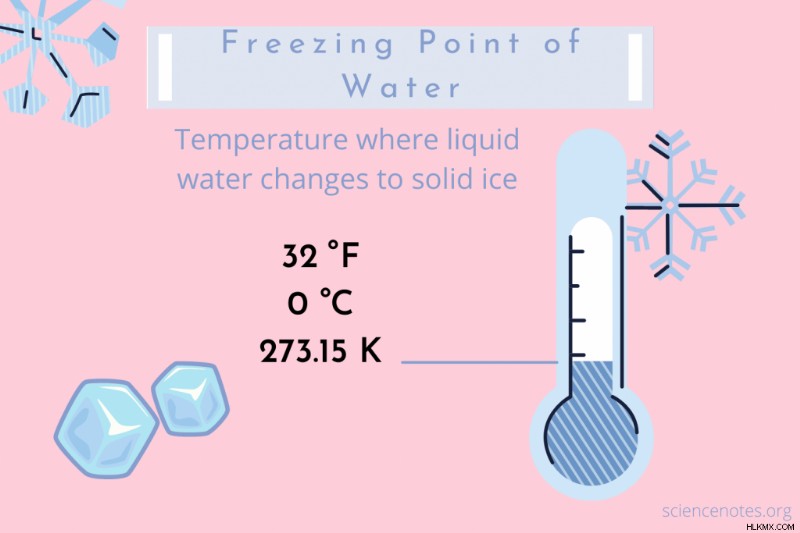
水の凝固点の温度は 32 °F、0 °C、または 273.15 K です。 .ケルビン スケールは絶対温度スケールであるため、ケルビン温度には度記号がないことに注意してください。これは、液体の水が 1 気圧で固体の氷になる相転移を起こす温度です。
凝固点と融点の違い
凝固点は液体が固体に変化する温度で、融点は固体が液体に変化する温度です。ほとんどの実用的な目的では、2 つの温度は同じです。したがって、水の融点も 32 °F、0 °C、または 273.15 K です。
純水の凝固点は、通常の凝固点または融点よりもはるかに低い場合があります。その理由は、水を過冷却しやすいからです。過冷却水とは、結晶形成を可能にする不純物、気泡、または表面欠陥がない水です。滑らかな容器に入った非常に純粋な水は、固体が凍る前に -40 ~ -42 °F (-40 °C) の温度に達することがあります!
凝固点を変化させる要因
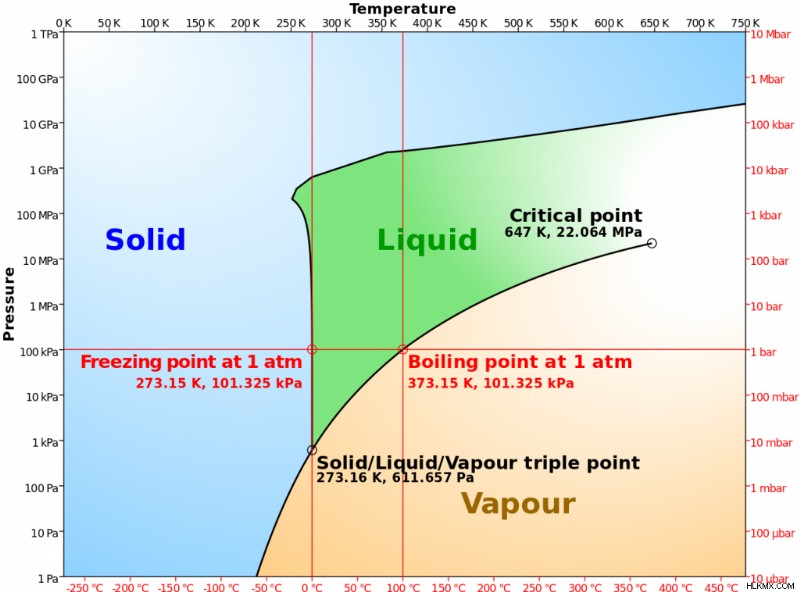
相図を見ると、凝固点温度が圧力に依存することがわかります。ほとんどの物質では、圧力を 1 気圧未満に下げると凝固点が下がります。しかし、水の場合は逆です。最初に圧力を上げると、凝固点が低くなります。その理由は、水分子間の水素結合により、液体は固体よりも密度が高くなり、安定性が高くなるからです。非常に低い圧力で、水は液体になることなく、水蒸気から氷に直接変化します。
不純物も水の凝固点に影響を与えます。ほとんどの場合、物質 (砂糖、塩、アルコールなど) を溶かすと凝固点が下がります。これを凝固点降下といいます。これは、粒子の化学的性質ではなく、水に追加された粒子の数に依存することを意味します。リーズ大学の科学者は、凝固点降下の例外を発見しました。塩である硫酸アンモニウムは、実際に水の凝固点を上昇させます。
ほこりや花粉など、水に溶けない粒子も水の凝固点を上昇させます。粒子は核生成点として機能します。基本的に、それらは水分子に結合点を与え、氷への結晶化プロセスを開始します。スキー リゾートはこの特性を利用して、氷点以上の温度で雪を作ります。
参考文献
- アトキンス、P.W. (2017)。 物理化学の要素 . ISBN 978-0-19-879670-1.
- ペダーセン、U.R.;ら。 (2016 年 8 月)。 「凍結と融解の熱力学」。 ネイチャー コミュニケーションズ . 7 (1):12386. doi:10.1038/ncomms12386
- Zachariassen, K.E.; Kristiansen, E. (2000 年 12 月)。 「自然界における氷の核生成と反核生成」. 凍結生物学 . 41 (4):257–79. doi:10.1006/cryo.2000.228