システムのエントロピーとは、使用できない単位温度あたりの熱エネルギーの量を指します。分子運動は仕事をもたらします。したがって、エントロピーは、システムの無秩序またはランダム性の尺度でもあります。オブジェクトが仕事をするために使用できないエネルギーを計算します。また、システム内で原子がとることができる配置の数も測定します。熱力学第二法則によれば、エントロピーは時間の方向に関係なく同じままです。エントロピーは、システムが可能な限り無秩序な状態にある場合にのみ一定になります。三重点では、特定の物質の 3 つの相 (気体、液体、固体など) が同時に共存できます。したがって、水の三重点ではエントロピーは一定です。エントロピーに基づく自然変化の方向は、いくつかの現象を説明できます。ドイツの物理学者ルドルフ・クラウジウスは、1850 年に 19 世紀の物理学の重要な要素を導入しました。
エントロピーの解釈
- フォン ノイマンは密度行列を使用して、エントロピーの概念を量子統計力学の量子ドメインに拡張しました。
- 情報理論の文脈において、システムが信号をどれだけ効率的に送信するか、または送信された信号で失われる情報量の尺度を指します。
- 動的システムでは、エントロピーはシステムの複雑さが増すことを表します。また、単位時間あたりの情報フローの平均速度も計算します。
- 社会学によると、エントロピーとは、社会システム (法律、組織、慣習など) における構造の社会的劣化または自然崩壊です。
- 宇宙が最大の均質性に近づく傾向は、宇宙論ではエントロピーと呼ばれます。一定の温度は、一定のエントロピーを意味します。
- しかし、エントロピーは現在、物理学や数学とは関係のない他の多くの分野で使用されており、その厳密な定量的特徴が失われていることを認めざるを得ません.
エントロピーとその性質
- エントロピーは熱力学の関数です。
- 状態関数です。選択された道ではなく、システムの状態によって結果が決まります。
- 一般的には S で表されます。ただし、正常な状態では、S° で表されます。
- J/Kmol は SI 単位です。
- Cal/Kmol は CGS の単位です。
- システムのエントロピーは広範な性質です。つまり、システムのサイズや範囲に比例して拡大します。
孤立したシステムは無秩序になり、エントロピーが大きくなります。化学反応がより多くの生成物に分解されると、エントロピーも増加します。温度が高いシステムでは、温度が低い場合よりもランダム性が高くなります。これらの例では、エントロピーが規則性の減少とともに増加することは明らかです。
エントロピーの順序:気体> 液体> 固体
エントロピーの変化とその計算
エントロピー変化の一部として、プロセスは、等温的に可逆的に放出または吸収された熱量を絶対温度で割ったものとして定義されます。エントロピー式は次のとおりです:
ΔS =qrev,iso/T.
高い温度と低い温度で同じ量の熱を加えた場合、ランダム性は低い温度で最大になります。つまり、温度はエントロピーに反比例します。
- 熱力学的に、自発的なプロセスは元に戻せません。
- しばらくすると、不可逆的なプロセスが平衡に達します。
総エントロピー変化、ΔTotal =ΔSurroundings + ΔSystem
総エントロピー変化は、システムとその周囲のエントロピー変化の合計に等しい.
システムが温度 T1 で熱 q を失い、周囲が温度 T2 で受け取った場合、合計 ΔS は次のように計算できます。
Δシステム =-q/T1
∆周囲 =q/T2
Δ合計 =-q/T1 + q/T2
- ΔTotal が正の場合、プロセスは自発的です。
- ΔTotal が負の場合、プロセスは自発的ではありません。
- ΔTotal がゼロの場合、プロセスは平衡状態にあります。
理想気体が可逆的に等温膨張すると、エントロピーが変化します
ΔS =qrev,iso/T.
熱力学の第一法則に従い、
ΔU =q + w
理想気体の等温膨張は、ΔU =0
qrev =-wrev =nRTln(V2/V1)
したがって、
ΔS =nRln(V2/V1)
気化エントロピーの役割
液体が蒸気に変わると、エントロピーが増加します。分子運動の増加は、ランダムな運動を引き起こします。
気化エントロピーは、気化エンタルピーを沸点で割った値に等しくなります。次のように表現できます。
ΔvapS =ΔvapH/Tb
化合物の形成の標準エントロピー
エントロピー変化は、標準状態の元素から標準状態の化合物が 1 モル生成されるときに発生します。
自発性の役割
- 発熱反応では、外部環境がプラスであるため自発的な反応があり、合計がプラスになります。
- 吸熱反応は、システムが正で周囲が負の場合に発生しますが、全体の合計は正です。
- 自由エネルギー変化基準の使用は、エントロピー変化基準を使用するよりも優れています。前者はシステムの自由エネルギー変化のみを必要とするのに対し、後者はシステムと周囲の両方のエントロピー変化を必要とするからです。
エントロピーにおけるネゲントロピーの影響
ネゲントロピーはエントロピーの逆です。物事がより秩序立っていることを示しています。順序とは、構造、組織、および機能を意味します。ランダム性やカオスに反対します。
太陽系などの恒星系はネゲントロピーの一例です。
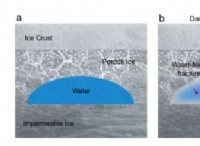
水の三重点
- 物質の三重点は、物質が 3 つの相 (固体、液体、気体) のすべてで平衡状態で存在できる温度と圧力です。
- スリーウェイ ジャンクションでは、物質の 3 つの相 (固体、液体、蒸気) が熱平衡状態で共存できます。
- 他のすべての温度では、熱平衡は 2 つ (または 1 つ) の段階でのみ発生します。最終的に、氷、水、水蒸気はすべて同じ温度になります。
- 空気の存在がバランスを崩します。
水の三重点におけるエントロピー定数
三重点は、固体、液体、および気体相の間の同時平衡状態です。
このような場合、単純に次のように書くことができます:
ΔS =ΔH/T
ΔG =0 の結果。273 K での水のモル (m) エンタルピーの場合、

可逆断熱膨張時のエントロピー変化
断熱プロセスの間、熱交換はゼロ (q =0) であり、一定のエントロピー (等エントロピー) で可逆断熱膨張が起こることを示します。
q =0
したがって、
ΔS =0.
可逆断熱膨張は等エントロピーですが、不可逆断熱膨張はそうではありません。
ΔS はゼロではありません。
結論
オブジェクトのエントロピーは、仕事を実行するために使用できないエネルギーの量を表します。エントロピーは、システム内で原子が取りうる配置の数の尺度でもあります。
熱力学の第二法則により、エントロピーは時間の方向に関係なく一定のままです。ただし、エントロピーは、システムが最大の無秩序状態にある場合にのみ一定になります。
三重点とは、気体、液体、固体など、物質の 3 つの異なる相が共存できる温度と圧力です。その結果、水の三重点ではエントロピーは一定になります。したがって、水の三重点ではエントロピーは一定です。