科学の謙虚な教訓は、人類の最も素晴らしい発明の多くに関してさえ、自然が最初にそこにたどり着いたということです. 2020 年のノーベル化学賞の受賞者は、ゲノム編集の革新的な方法を特定し、開発した功績を共有する 2 人の科学者に贈られます。この方法により、研究者は微生物、植物、動物の細胞のゲノムを簡単かつ正確に変更して調査することができました。そして、10 年前でさえ計り知れないほどの有効性。しかし、彼らの仕事から生まれた技術は、革命的でありながら、おそらく 10 億年以上前にバクテリアで最初に進化し、最近まで気づかれなかったイノベーションから生まれました。
Max Planck Unit for the Science of Pathogens Institute for Infection Biology の Emmanuelle Charpentier とカリフォルニア大学バークレー校の Jennifer Doudna は、CRISPR/Cas9 ゲノム編集に関する研究で知られています。 「遺伝子のはさみ」として。この賞は、2 人の女性がノーベル科学賞を受賞した初めてのことです。
2012 年の重要な論文で、Charpentier と Doudna は、バクテリアと古細菌に見られる古代の免疫システムの重要な構成要素を改造して DNA を編集し、本質的に「生命のコードを書き換える」ことができることを示した.
それから 8 年間、この発見は生命科学を変革し、ゲノム編集は世界中の研究室で一般的なものになりました。これにより、研究者は遺伝子の機能を自由に調べることができるようになり、分子生物学の分野が飛躍的に進歩しました。植物育種の新しい方法を革新する。また、鎌状赤血球症などの病態に対して有望な新しい遺伝子治療を開発することも含まれています。その一部は現在臨床試験中です。
CRISPRに関連する知的財産に関する論争が広く報道されているため、ノーベル委員会の選択は間違いなく物議を醸すものとして迎えられるでしょう.リトアニアのヴィリニュス大学のヴィルジニウス・シクシュニスは、シャルパンティエとドウドナとほぼ同時期に、バクテリアのこれらの遺伝的特徴をゲノム編集ツールとして使用するというアイデアを独自に開発しました。他の 2 人の科学者、マサチューセッツ工科大学の Feng Zhang とハーバード大学の George Church も、CRISPR 技術の初期の共同発見者および開発者としてしばしば認められており、彼らの除外は議論を煽るでしょう。しかし、科学界の誰も、Charpentier と Doudna の研究が今日の CRISPR の多作で画期的な使用の基礎を築いたことに異議を唱えませんでした。
CRISPR/Cas システムとは?
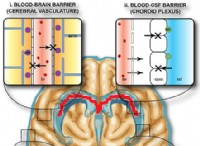
CRISPR/Cas の話は、1980 年代後半から 1990 年代前半にかけて、ほとんどの原核生物 (多くのバクテリアとほぼすべての古細菌を含む) がゲノムに奇妙な構造を持っているという観察から始まりました。それらの DNA の一部は、他の短い可変「スペーサー」配列が散在する、多くの短い、特徴的に反復する塩基配列で構成されています。生物学者は、この構造を CRISPR (クラスタ化された規則的に間隔をあけた短い回文反復) と呼びました。それに隣接するのは、DNA を切断できる酵素の遺伝子の CRISPR 関連システム (Cas) です。その後、科学者は、スペーサー配列の DNA がウイルス DNA の断片と同一であることに気付きました。


この取り決めにより、フランスの研究者チームは 2005 年に、細菌に対して CRISPR/Cas システムが持続的なウイルス攻撃者と戦うための一種の免疫システムとして機能する可能性があると提案するようになりました。彼らは、細菌がウイルス感染を生き延びたとき、将来の参照のために自分のゲノムの CRISPR 部分に除去されたウイルス DNA の小さな断片を保存したことを示唆しました。ウイルスがそれらのバクテリアまたはその子孫を再び攻撃した場合、バクテリアは何らかの方法でファイル上のウイルス DNA を使用して、Cas 酵素を侵入者に向け、それらを迅速に排除することができます.
Charpentier と Doudna が開発した技術は、細菌からこの正確なゲノム スライス機能を借りて、CRISPR 遺伝子構造をターゲティング ツールとして使用し、Cas9 酵素を使用して切断する、より一般的なゲノム編集ツールに変えました。
Charpentier と Doudna はどのようにして CRISPR を遺伝子編集に転用したのですか?
Charpentier と Doudna は、反復ウイルス侵入者に対する細菌の CRISPR/Cas9 防御に関与する分子機構の概要を説明することから始めました。基本的に、ウイルスが攻撃すると、生き残ったバクテリアはウイルス DNA の一部を CRISPR アレイに組み込みます。そのウイルスが彼らまたはその子孫を再び攻撃すると、細菌はウイルス DNA を含む CRISPR の一部を RNA に転写します。この RNA 分子は、Charpentier によって以前に同定された 2 番目の RNA 分子と共に、Cas9 タンパク質を標的、つまり再び侵入しようとしているウイルスの対応する DNA に誘導します。そこでは、分子複合体が遺伝子のはさみとしての役割を果たし、ウイルス DNA を切断して侵入者を無力化します。
これをより一般化された遺伝子編集ツールに変えるために、Charpentier と Doudna は他の同僚と共に、2 種類の RNA を単一の「ガイド RNA」に融合させました。彼らは、Cas9 と共に、このより合理化されたシステムが試験管内のウイルス DNA を見つけて切り取ることができることを示しました.
CRISPR 編集は、遺伝子や DNA の一部を削除するだけで済みます。しかし、科学者たちは、細胞の自然な修復メカニズムを利用して、自分たちで作った DNA 配列を外科的切断部位に導入する方法も見つけ出し、新しい遺伝子コードを追加したり、特定の突然変異を修正したりできるようにしました。
CRISPR が他のゲノム編集技術よりも優れている点は何ですか?
研究者は、1970 年代から、「カット アンド ペースト」組換え遺伝子編集技術を使用して細胞を改変することができました。しかし、これらの方法は、天然に存在する細菌の酵素にも基づいていたため、CRISPR が達成できるレベルの精度に欠けていました。これは、そのような組換えアプローチが十分な精度で固有の DNA 配列を標的とすることができないことが多かったためです。ゲノムに沿った意図しない場所で切断が行われ、予測不可能な結果が生じる可能性があります。より長い配列をより特異的に標的とするように酵素を設計することもできますが、それは CRISPR よりもはるかに困難で複雑なプロセスでした。使いやすさは、CRISPR をユビキタスにするのに大いに役立ちました。
CRISPR に課題がないわけではありません。たとえば、偶発的な変化を引き起こしたり、生体内で意図しない反応 (免疫反応を含む) が発生したりする可能性があります。そのため、科学者はより洗練されたバージョンの CRISPR の開発に向けて努力を続けています。
また、CRISPR は必ずしもすべての仕事に最適なツールというわけではなく、ゲノム編集技術の最後の言葉でもありません。科学者は、RNA 干渉 (RNAi) や、転写活性化因子様エフェクターヌクレアーゼ (TALEN) やメガヌクレアーゼなどの酵素を使用して、ゲノムを書き換えています。さらに、一部の研究者は現在、CRISPR や TALEN のように細胞の自然な DNA 修復メカニズムを利用しないゲノム編集ツールを開発しています。代わりに、エピジェネティクスと DNA を一度に 1 塩基ずつ書き換える方法に基づいた方法を見つけています。
CRISPR の使用をめぐってどのような論争がありますか?
意図的にゲノムを変更する技術は、その倫理的使用と人工生物によってもたらされる潜在的な危険性の両方をめぐって、常に論争に巻き込まれてきました。 CRISPR も例外ではありません。特に、科学者が遺伝的状態の宿主の治療法を模索する中で、微生物、植物、動物の細胞 (ヒト細胞を含む) を編集するために既に使用されているためです。 CRISPR の使いやすさは、軽率なアクションの可能性を考慮する価値があります。
2018 年、研究者の He Jiankui は、CRISPR を使用して双子の赤ちゃんのゲノムを編集し、HIV に対する耐性を持たせようとしたことを報告し、世界を驚かせました。これは、遺伝子編集の倫理に関する長年の議論を再燃させました。この発表の直後、この研究は恐ろしく、リスクが高く、時期尚早であると述べた Doudna 自身を含め、科学界全体から広く非難されました。 (Doudna は、CRISPR を使用するための適切なガイドラインを開発するよう、国際的な科学コミュニティに積極的に働きかけてきました。)
しかし、CRISPR の潜在的な用途について科学者が懸念しているのは、生殖細胞系編集の倫理だけではありません。もう 1 つは、遺伝子ドライブとして知られているものを作成するためにどのように適用できるかということです。これにより、研究者は、関心のある形質が親から子孫に受け継がれる可能性を劇的に高めることができます。これはこれまで実験室でしか試みられていませんでしたが、一部の科学者は、いつの日か野生の侵入種や病気を媒介する昆虫を制御するためにそれを使用したいと考えています.しかし、最近のモデリングの取り組みによると、そうすると、遺伝子ドライブが標的集団を超えて広がり、制御不能になるという懸念されるリスクが伴う可能性があります.
その結果、論争の的となっている CRISPR 技術の応用に関しては、研究者は慎重に進めています。しかし、CRISPR が基礎科学と病気の研究を新しい時代に送り出したことは否定できません。
この投稿は、受賞作品に関する詳細を追加して更新されました。
Roger Penrose、Reinhard Genzel、Andrea Ghez が今年のノーベル物理学賞を受賞し、Harvey Alter、Michael Houghton、Charles Rice が生理学または医学のノーベル賞を受賞しました。