この発見の中心には、カリフォルニア大学バークレー校の研究者による尊敬されるジャーナル「自然微生物学」に掲載された画期的な研究と、ローレンスバークレー国立研究所の高度な光源ビームラインの協力者があります。分子および細胞生物学の著名な教授であるエヴァ・ノガレス博士が率いる研究チームは、高度なイメージング技術と計算分析を採用して、メタノスピリルム・ハンテイのS層のタンパク質結晶化の複雑な詳細を解読しました。
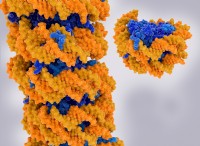
3次元での生物学的構造の視覚化を可能にする洗練されたイメージング技術であるCryo-Electron断層撮影を利用することにより、研究者はS層の高解像度のスナップショットをキャプチャすることができました。この前例のないレベルの詳細は、「ベースプレート」と「スパイク」と呼ばれる2つの異なるタンパク質複合体の存在を明らかにしました。
ベースプレートは、タンパク質結晶が構築される基礎として機能します。タンパク質サブユニットの六角形の配列で構成されたベースプレートは、スパイク複合体のその後のアセンブリの安定したプラットフォームを提供します。スパイク複合体は、順番に、クラウンに似た6つの追加タンパク質に囲まれた中央のスパイクタンパク質で構成されています。これらのスパイク複合体はベースプレートから突き出ており、S層に可視結晶パターンを形成します。
タンパク質結晶化のダイナミクスを完全に理解するために、研究チームは計算分析に目を向けました。 Cryo-Electron断層撮影データをMolecular Dynamicsシミュレーションと統合することにより、タンパク質結晶の段階的なアセンブリプロセスを示す詳細なモデルを構築することができました。これらのモデルは、ベースプレートの形成が結晶化プロセスを開始し、その後スパイク錯体の連続的な添加が続くことを明らかにしました。
さらに、チームは、スパイク複合体内の特定のアミノ酸残基がタンパク質間相互作用の媒介において重要な役割を果たし、結晶パターンの正確なアセンブリを導くことを発見しました。これらの発見は、S層上のタンパク質結晶の自己組織化の根底にある絶妙な分子認識メカニズムを強調しています。
この研究の意味は、Hunganospirillum Hungateiの研究を超えています。微生物S層のタンパク質の結晶化を支配する基本原理を解明することにより、科学者は、より広い生体原性の分野について貴重な洞察を得る。バイオミネラル化には、生物が鉱物を活用して骨、歯、貝殻などの複雑な構造を構築する幅広い自然プロセスが含まれます。タンパク質ベースのバイオミネラル化の背後にあるメカニズムを理解することは、材料科学、バイオテクノロジー、医学研究など、多様な科学分野を進めるための計り知れない可能性を秘めています。
Methanospirillum hungateiのS層に関するタンパク質結晶化に関する研究は、分子レベルでの生体原性プロセスの理解における著しい飛躍を表しています。科学者はこれらの生物学的現象の複雑な詳細を深く掘り下げているため、カスタマイズされた特性と機能性を備えた新しい材料の設計と統合のための自己組織化の力を活用する新しい機会を解き放ちます。