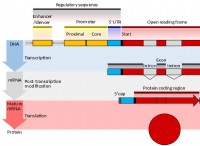
形成:
カチオン:
* 電子の損失: 原子が1つ以上の電子を失うと陽イオンが形成されます 。この電子の損失は、正電荷をもたらします 原子には電子(負電荷)よりも多くの陽子(正電荷)があるためです。
* 金属: 金属は電子を失い、カチオンを形成する傾向があります。 、つまり、外側のシェルから電子を除去するために多くのエネルギーを必要としません。
* 例: ナトリウム(Na)には、その最も外側のシェルに1つの電子があります。この電子を失うと、+1電荷のナトリウム陽イオン(Na +)になります。
アニオン:
* 電子のゲイン: 原子が1つ以上の電子を獲得すると、陰イオンが形成されます 。この電子の獲得は、負電荷になります 原子にはプロトンよりも多くの電子があるためです。
* 非金属: 非金属は、電子が比較的高い aphinities を持っているため、電子を獲得して形成する傾向があります 、つまり、彼らは容易に電子を外のシェルに受け入れます。
* 例: 塩素(CL)には、最も外側の殻に7つの電子があります。 1つの電子を獲得すると、-1電荷の塩化物アニオン(CL-)になります。
キーテイクアウト:
* カチオン: 通常、金属によって電子を失うことによって形成される正電荷。
* アニオン: 通常、非金属によって電子を獲得することによって形成される負電荷。
例:
* nacl(テーブルソルト): ナトリウム(Na)は1つの電子を失い、Na+(陽イオン)になり、塩素(Cl)は1つの電子を獲得してCl-(アニオン)になります。これらの反対に帯電したイオン間の静電引力は、イオン化合物NaClを形成します。
* mgo(酸化マグネシウム): マグネシウム(mg)は2つの電子を失い、mg2+(陽イオン)になり、酸素(O)は2つの電子を獲得してO2-(アニオン)になります。
注: 失われたまたは獲得した電子の数は、周期表の要素の位置とその電子構成によって異なります。