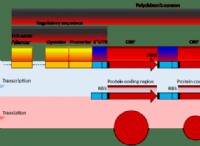
1。ペプチド結合:
*これらは一次結合です そのリンクアミノ酸が一緒にリンクして、ポリペプチド鎖を形成します。
*それらは共有結合です 1つのアミノ酸のカルボキシル基と次のアミノ酸のアミノ基との間に形成されます。
2。水素結合:
* 二次結合 これは、アルファヘリックスやベータシートなどのタンパク質構造の形成に不可欠です。
* 1つのアミノ酸の水素原子と、別のアミノ酸の酸素または窒素原子の間に形成されます。
3。ジスルフィド結合:
* 三次結合 タンパク質中のシステイン残基間のその形態。
*それらは共有結合です タンパク質の3次元構造を安定させるのに役立ちます。
4。ファンデルワールスの相互作用:
* 弱い、短距離相互作用 タンパク質の形状を一緒に保持するために重要です。
*それらは、原子の周りの電子分布の一時的な変動から生じます。
5。疎水性相互作用:
* 非共有相互作用 タンパク質の折り畳みを3次元形状に駆り立てます。
*それらは、水との接触を避けるためにタンパク質の内部に集まる傾向がある非極アミノ酸側鎖の間で発生します。
6。イオン結合:
* 静電相互作用 それは、反対に帯電したアミノ酸側鎖の間に形成される可能性があります。
*それらはタンパク質構造の安定性に貢献しています。
タンパク質の特定のタイプと数の結合数は、アミノ酸配列、タンパク質の機能、およびその環境によって異なります。