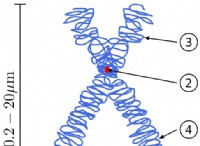
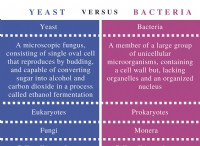
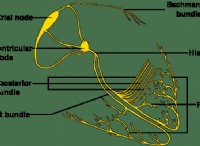
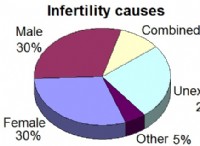
重要なコンポーネント:
* 複数のサブユニットを備えた酵素: アロステリック酵素は通常、特定の第四紀構造に配置されている複数のポリペプチド鎖(サブユニット)を持っています。
* アクティブサイト: これは、基質が結合し、化学反応が起こる場所です。
* 規制サイト(アロステリックサイト): 活性部位とは異なる酵素上の部位。これは、エフェクター分子が結合する場所です。
* エフェクター分子: この分子は、アクティベーターのいずれかです (酵素活性の増加)または阻害剤 (酵素活性の低下)。
メカニズム:
1。エフェクターの規制サイトへの結合: この結合イベントは、酵素の構造に立体構造の変化を引き起こします。
2。立体構造の変化: この構造シフトは、基質に結合するアクティブサイトの能力に影響します。
3。活動の変更:
* アクティベーター: 立体構造の変化は、基質に対する酵素の親和性を高め、その活性を高めます。
* 阻害剤: 立体構造の変化は、基質に対する酵素の親和性を低下させ、その活性を低下させます。
アロステリック調節の特性:
* 酵素活性の微調整: エフェクター濃度の小さな変化に反応して、酵素活性の正確で敏感な制御を可能にします。
* 代謝物による規制: エフェクターは、多くの場合、酵素が関与する経路内の代謝産物であり、フィードバックメカニズムを提供します。
* s状の動力学: 基質濃度と酵素活性の関係は線形ではなく、S字型(S字型)であり、活性部位への基質の協調結合を示しています。
例:
* ヘモグロビン: 1つのヘム群への酸素結合は、他のヘム群の親和性に影響を及ぼし、協同的結合とアロステリックの調節を実証します。
* ホスホフルクトキナーゼ(PFK): ATP(阻害剤)およびADP(活性化因子)によって調節される解糖における重要な酵素。
要約: アロステリック調節には、酵素活性を微調整するためのタンパク質構造、リガンド結合、および立体構造の変化の複雑な相互作用が含まれます。これは、代謝経路を調節し、細胞の恒常性を確保するための重要なメカニズムです。