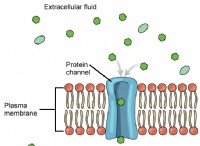
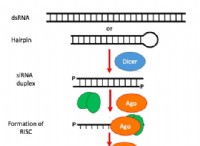
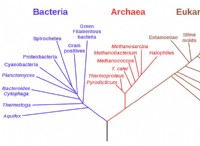
これが故障です:
* 基本構造: すべてのアミノ酸は、共通の基本構造を共有しています。アミノ基(-NH2)、カルボン群(-COOH)、水素原子(-H)、および可変Rグループに結合した中心炭素原子(アルファ炭素)。
* r-groupバリエーション: Rグループは、各アミノ酸を一意にするものです。それは可能です:
* 非極性(疎水性): これらのRグループは主に炭化水素で構成されており、水を避ける傾向があります。例には、グリシン、アラニン、バリンが含まれます。
* 極性(親水性): これらのRグループには、ヒドロキシル(-OH)、カルボニル(-C =O)、アミン(-NH2)グループなどの極性官能基が含まれており、水性を生成します。例には、セリン、スレオニン、アスパラギンが含まれます。
* 充電(親水性): これらのRグループは、生理学的pHで正味の正または負の電荷を持っています。例には、リジン(陽性)とグルタミン酸(陰性)が含まれます。
* 特別なケース: 一部のアミノ酸は、プロリン(環状構造を形成する)やシステイン(ジスルフィド結合を形成)などのユニークな特性を持っています。
R-Groupsが重要な理由:
Rグループの多様性により、アミノ酸は広範囲のタンパク質構造と機能を形成することができます。タンパク質のアミノ酸の特定の配列は、次のことを決定します。
* 3次元形状: Rグループの相互作用(水素結合、疎水性相互作用、イオン結合)がタンパク質の折りたたみを決定します。
* 関数: Rグループは、活性部位に参加したり、他の分子に結合したり、タンパク質の安定性に寄与したりできます。
要約:
Rグループは、アミノ酸を区別する明確な特性であり、それぞれにユニークな特性を与え、本質的にタンパク質の膨大な多様性に貢献しています。