同位体 中性子の数が異なる元素の形です。元素のすべての同位体は、同じ原子番号と陽子の数を持っていますが、互いに異なる原子質量を持っています。元素の同位体は、類似した化学的性質を共有していますが、核の性質は異なります。
すべての元素には同位体があります。 81 の安定元素には 275 の同位体があります。ただし、安定同位体を持つ元素には、放射性同位体または放射性同位体も含まれます .一方、放射性元素には安定同位体がありません。 800 以上の放射性同位体が特定されています。放射性同位体には天然のものもあれば、実験室でしか生成されていないものもあります.
語源
同位体という用語は、1913 年にスコットランドの医師マーガレット トッドによって造られました。彼女は化学者フレデリック ソディにこの言葉を提案しました。彼はそれを化学と物理学で使用するために採用しました。この言葉はギリシャ語の isos に由来します (等しい) と topos (場所)。元素の同位体は、周期表の同じ位置を占めます。周期表上の元素の原子質量は、その元素の自然発生同位体の質量の平均です。
同位体表記
同位体を記述する一般的な方法は 2 つあります:
(1) 元素名または記号が最初にリストされ、その後にダッシュが続き、その後に同位体の質量数が続きます。たとえば、水素-3 または H-3 は、1 つの陽子と 2 つの中性子を含む水素同位体を指し、これらを合計すると質量数 3 になります。炭素-12 または C-12 は、6 つの陽子を含む炭素の安定同位体を指します。と 6 個の中性子。
(2) 元素記号の左上に質量数または質量数と原子番号を併記する。たとえば、6 つの陽子と 6 つの中性子を持つ炭素の同位体は 6 です。 C.理想的には、質量数は原子番号のすぐ上に配置されますが、型付き表記ではこれが常に可能であるとは限りません。
同位体の例
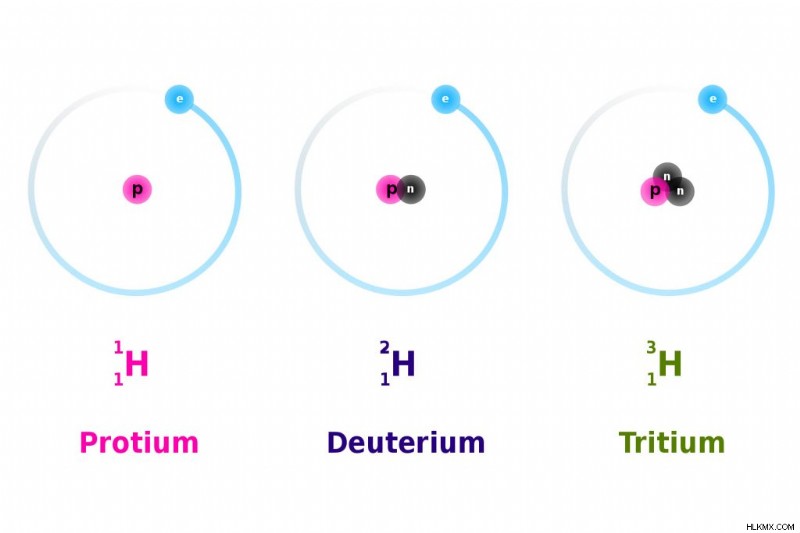
水素の同位体は、水素-1 (安定同位体であるプロチウム)、水素-2 (別の安定同位体である重水素)、および水素-3 (放射性同位体であるトリチウム) です。
ウラン 235 とウラン 238 は、ウランの 2 つの同位体です。どちらも地球の地殻に見られる天然の同位体です。
炭素 12 と炭素 14 は、2 つの炭素同位体です。炭素 12 は安定ですが、炭素 14 は放射性です。
親と娘の同位体
放射性同位体が放射性崩壊を受けるとき、開始同位体は親同位体と呼ばれます。崩壊は、1 つ以上の娘同位体を生成します。たとえば、ウラン 238 は、崩壊して娘同位体であるトリウム 234 になる親同位体です。
同位体 vs 核種
同位体とは、原子のサンプルを指します。個々の原子の陽子と中性子の数を調べると、それは核種と呼ばれます 要素の。核科学では、核種という用語は同位体という用語よりも好まれます。互いに質量数が同じ核種は 等圧線 と呼ばれます .たとえば、アルゴン 40、カリウム 40、カルシウム 40 は同重体です。
参考文献
- Nagel, Miriam C. (1982). 「フレデリック・ソディ:錬金術からアイソトープまで」 Journal of Chemical Education . 59 (9):739–740. doi:10.1021/ed059p739
- ソディ、フレデリック (1913)。 「原子内電荷」。 自然 92 (2301)、Springer Nature Publishing AG。 doi:10.1038/092399c0
- ストロムホルム、ダニエル。 Svedberg、テオドール(1909)。 「Untersuchungen über die Chemie der radioitin Grundstoffe II.」 (放射性元素の化学に関する調査、パート 2)。 Zeitschrift für anorganischen Chemie . 63 :197–206。







