化学では、制限反応物 化学反応で完全に使い果たされる反応物です。 制限試薬としても知られています ただし、現代の化学では、反応物と試薬は必ずしも同じものではありません。制限反応物について知っておくべきことは、その定義、見つけ方、問題の例などです。
反応物の定義の制限
制限反応物は、化学反応を「制限」するか、生成できる生成物の量を決定する反応物です。これは、化学量論または反応物と生成物のモル比に基づいています。反応物を組み合わせる場合、互いに完全にバランスが取れた量を常に使用するとは限りません。
たとえば、ホットドッグのパッケージとパンのパッケージを購入すると、通常、ホットドッグが 10 個とバンズが 8 個になります (おそらく、パン会社が製品をより多く販売できるようになるためです)。バンズ付きのホットドッグは何個作れますか?ホットドッグとパンの理想的な比率は 1:1 ですが、10:8 または 1:0.8 になります。ホットドッグがなくなる前にすべてのパンを使い切るので、パンは制限反応物です.残ったホットドッグは過剰な反応物です .制限反応物が理論収量を決定します。この場合、理論上の収量はパン付きホットドッグ 8 個です。
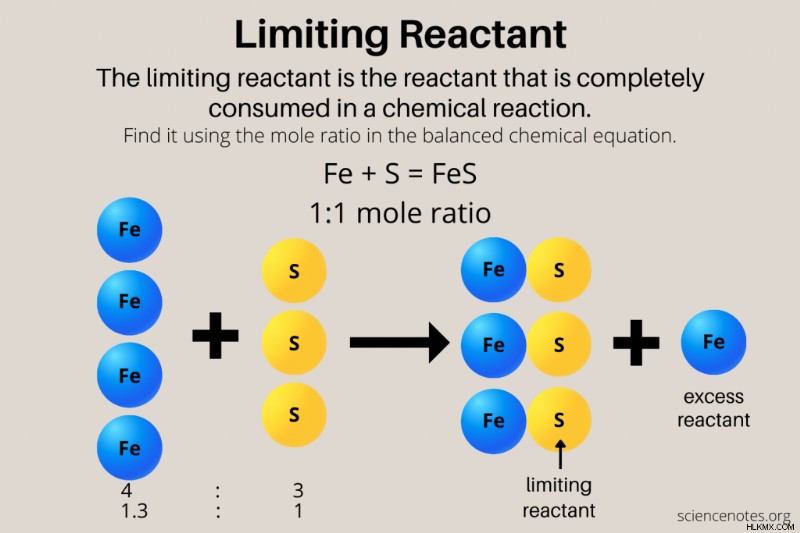
化学反応は、ホットドッグとパンの例とよく似ています。たとえば、鉄 (Fe) と硫黄 (S) が反応して硫化鉄 (FeS) が生成される場合を考えてみましょう。ホットドッグやパンと同じように、鉄と硫黄は 1:1 の比率で反応します:
Fe(s) + S(s) → FeS(s)
理想的な状況では、各物質のモル数が同じです。周期表を使用して、鉄と硫黄の原子質量を調べ、モル数をグラムに変換して、それらを量ることができます.したがって、55.85 グラムの鉄と 32.06 グラムの硫黄を反応させると、完全に反応して硫化鉄が形成されます。鉄と硫黄の両方が制限反応物です。各化学物質の質量の半分または各化学物質の 5 倍の量を使用する場合、鉄と硫黄が等モル量で存在する限り、結果は同じです。
ただし、通常、各反応物は一定量あるため、1 つの反応物が使い果たされ (制限反応物)、残りの反応物 (過剰な反応物) が残ります。 46グラムの鉄と32グラムの硫黄があるとしましょう.制限反応物はどれですか?
制限反応物を見つける方法
制限反応物を見つけるには、主に 2 つの方法があります。どちらの場合も、バランスの取れた化学式と、反応物と生成物のモル数から始めます。ほくろの数が与えられたら、素晴らしいです!通常、質量はグラム単位であり、グラムをモルに変換します。次に、反応物のモル比を比較するか、どちらの反応物が少量の生成物を生成するかを確認します:
反応物のモル比の比較
<オール>たとえば、46 グラムの鉄と 32 グラムの硫黄の間の反応では:
<オール>製品の量を比較する
<オール>必要に応じて、実際に使い果たされる量から過剰な反応物のモル数を差し引いて、過剰な反応物の量を計算します。次に、モル数をグラムに変換します。
繰り返しますが、46 グラムの鉄と 32 グラムの硫黄の間の反応の例を使用しましょう。
<オール>例
以下は、制限反応物を見つける方法を示す別の例です:
35.60 グラムの水酸化ナトリウムと 30.80 グラムのリン酸を反応させてリン酸ナトリウムと水を生成するときの制限反応物を見つけます。
まず、化学式とバランスの取れた化学式が必要です:
3 NaOH(aq) + H3 PO4 (aq) → Na3 PO4 (aq) + 3 H2 O(l)
反応物のモル比は 3 NaOH:1 H3 です。 PO4
では、水酸化ナトリウムとリン酸のモル数を求めてください。周期表の原子質量の使用:
- NaOH のモル質量 =40.00 グラム/モル
- H3 のモル質量 PO4 =98.00 グラム/モル
NaOH のモル =35.60 g / 40.00 g/mol =0.89 mol
H3 のモル数 PO4 =30.80 g / 98.00 g/mol =0.31 mol
水酸化ナトリウムとリン酸の実際のモル比は 0.89 :0.31 =2.87 です。
水酸化ナトリウムとリン酸の理想的なモル比は 3:1 =3.00 です。
モル比が 3 未満であるため、NaOH が制限反応物であることがわかります。比率が 3 を超えていた場合、リン酸が制限反応物でした。もちろん、反応物のモル数を生成物と比較することで、問題を処理して同じ答えが得られます。
参考文献
- ブレイディ、ジェームズ E.; Senese、フレデリック。 Jespersen、ニール D. (2007)。 化学:物質とその変化 .ジョン・ワイリー&サンズ. ISBN 9780470120941.
- ジュンタ、カルメン J. (2016). "名前って何?物質の量、化学量、および化学量論量。 J.Chem.教育する。 93(4):583-586. doi:10.1021/acs.jchemed.5b00690
- オルムステッド、ジョン。ウィリアムズ、グレゴリー M. (1997)。 化学:分子科学 .ジョーンズとバートレットの学習。 ISBN 0815184506.
- Zumdahl, Steven S. (2006). 化学原理 (第4版)。ニューヨーク:ホートン ミフリン カンパニー。 ISBN 0-618-37206-7.