コア コンセプト
このチュートリアルでは、双極子モーメントについてすべて学びます .まず、化学結合と分子における双極子モーメントの存在についての基本的な紹介から始めます。次に、双極子モーメントを計算するために使用される式について説明し、それらの分類を (スカラーではなく) ベクトル量として説明します。最後に、正味の双極子モーメントを決定する際の分子構造の重要性を示すいくつかの例を示します。
他の記事で取り上げるトピック
- 電子軌道と軌道形状
- 電子親和力とは
- シグマ ボンドとパイ ボンド
- フォーマルチャージとは
- 陽イオンと陰イオン
双極子モーメントの概要
双極子モーメントは、正電荷と負電荷の分離があるシステムで発生します。したがって、それらはイオン結合と共有結合の両方で見つけることができます。双極子モーメントは、化学的に結合した原子間の電気陰性度の違いにより発生する不均等な電子分布の結果です (電子は電気陰性度の高い原子に向かって移動する傾向があるため)。その結果、電気陰性度の差が大きくなると、双極子モーメントが大きくなります。
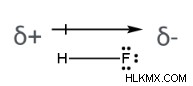
大きさと方向の両方を持っているため、双極子モーメントはベクトル量と見なされます。以下に示されているのは、フッ化水素酸の分子に存在する双極子モーメントの図です。矢印は分子内の電子密度のシフトを表します。それは、電気陰性度がより低い (そしてより正電荷を帯びた) 水素原子から離れて、電気陰性度がより高い (そしてより負電荷を帯びた) フッ素原子を指しています.
結合双極子モーメントと分子双極子モーメントの違いに注意することが重要です。結合双極子モーメントは、分子内の 2 つの原子間の化学結合の極性の尺度です。一方、分子双極子モーメント (正味双極子モーメントとも呼ばれます) は、分子全体の極性の尺度です。したがって、多原子分子 (つまり、3 つ以上の原子で構成される分子) では、正味の双極子モーメントは、分子内に存在するすべての結合双極子モーメントのベクトル和です。さらに、正味の双極子モーメントは、VSEPR 理論を使用して予測できる分子の形状の影響を受けます。
双極子モーメント式
化学結合の双極子モーメントを計算するには、次の式を使用します:µ =qr (ここで、μ は結合双極子モーメント、q は分離された電荷の大きさ、r は電荷間の分離距離です)。双極子モーメントの SI 単位はクーロン メートル (C-m) です。ただし、最も一般的にはデバイ (D) で測定されます。 1 デバイは 3.336 x 10 クーロンメートルに相当します。
前述のように、双極子モーメントは大きさ (電気陰性度の差によって決定される) と方向 (電気陰性度の高い原子に向かう電子の移動に基づく) の両方を持っているため、ベクトル量です。したがって、対称分子が互いに打ち消し合う個々の結合双極子モーメント (大きさは等しいが方向が反対) を持っている場合、分子の正味の双極子モーメントがゼロになる可能性があります。この場合、分子は複数の極性結合を含んでいるにもかかわらず、非極性として分類されます。
双極子モーメントの例
CO2 双極子モーメント
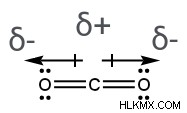
二酸化炭素の分子 (CO2 )、2 つの極性共有結合があります。それぞれが中心の炭素原子と結合した酸素原子を含みます。酸素は炭素より電気陰性度が高いため、両方の酸素原子は部分的に負の電荷を持ち、炭素原子は部分的に正の電荷を持ちます。結果として、分子の結合双極子モーメントを表す 2 つの矢印は、炭素原子から離れて酸素原子の方を向いています。さらに、中心原子は他の 2 つの原子と結合し、孤立電子対を欠いているため、CO2 線状構造(結合角180°)を持っています。したがって、2 つの結合双極子モーメントは反対方向に実行され、互いに打ち消し合います。つまり、CO2 ゼロの正味双極子モーメントを持ち、非極性分子です。
H2 O双極子モーメント
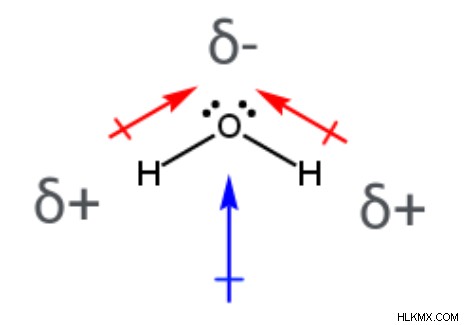
水分子 (H2 O)、2 つの極性共有結合があります。それぞれが中心の酸素原子と結合した水素原子を含みます。分子の結合双極子モーメントを表す 2 つの矢印は、電気陰性度の低い水素原子から離れ、電気陰性度の高い酸素原子を指しています。さらに、酸素原子は部分的に負の電荷を持ち、2 つの水素原子は部分的に正の電荷を持ちます。中心の酸素原子は他の 2 つの原子と結合し、孤立電子対を 2 つ含むため、H2 の構造は O は曲がっています (結合角は 104.5°)。二酸化炭素分子とは異なり、水分子の個々の結合双極子モーメントは相殺されません。つまり、H2 O は正味の双極子モーメントを持ち、極性分子です。
NH3 双極子モーメント
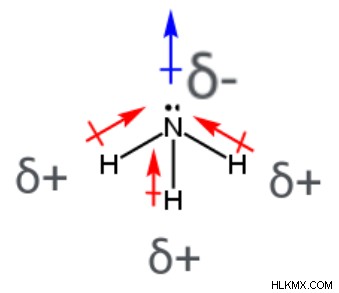
アンモニアの分子 (NH3 )、3 つの極性共有結合があります。それぞれが中心の窒素原子と結合した水素原子を含みます。電子は、電気陰性度の高い窒素原子に向かって移動し、電気陰性度の低い水素原子から離れる傾向があります (3 つの個々の結合双極子モーメントの矢印で示されているように)。窒素原子には部分的に負の電荷があり、水素原子には部分的に正の電荷があります。中心の窒素原子は他の 3 つの原子と結合し、孤立電子対を 1 つ持つため、アンモニアの分子は三角錐形 (結合角 107°) になります。アンモニア分子の個々の結合双極子モーメントは相殺されません。つまり、NH3 正味の双極子モーメントを持ち、極性分子です。
さらに読む
- 極性と非極性の結合と分子
- 原子価結合理論
- ルイス ドット構造
- 共鳴構造