コア コンセプト
この記事では、量子力学の重要な構成要素である原子価結合理論と、混成と結合順序の理解におけるその応用について学びます。
他の記事で扱っているトピック
- 量子数と軌道形状
- パウリ排除原則
- アウフバウ原則
- フンドの法則
- シグマ ボンドとパイ ボンド
原子価結合理論の基礎
原子価結合理論は、分子軌道理論とともに、原子間の結合の形成を説明するのに役立つ 2 つの基本的な結合理論の 1 つです。原子価結合理論は、原子間の共有結合の性質を説明するのに特に役立ちます。
原子価結合理論の背後にある本質は、共有結合を原子軌道の重なりとして表すことにあります。これは、結合が共有粒子としてではなく、電子雲として扱われるという点で、ルイス構造理論とは異なります。
主に、ハイブリッド化された S、P、および D 軌道の重なりに焦点を当てます。
原子価結合理論における軌道の重なり
基本的に、化学結合には、互いの価電子に引き付けられる 2 つの原子の原子核が含まれます。 2 つの原子核が互いに接近すると、この引力が増加します。ただし、2 つの原子は、原子核と電子の電荷が似ているため、距離が短くなると互いに反発し合います。最終的に、反発力が相互作用を支配する前に、原子が互いに最も引き付けられる距離が存在します。 2 つの原子がこの完全な引力距離に達すると、それらは化学的に結合していると見なされます。
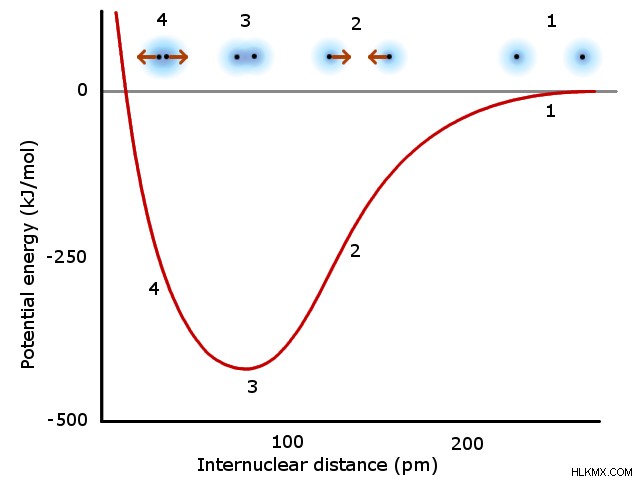
原子価結合理論では、このような相互作用は、各原子が 1 つの電子を提供する、半分満たされた化学軌道の下でのみ発生します。化学結合が形成されると、対になった結合形成電子が両方の原子の軌道を満たし、電子対を「共有」します。空間的には、これには、2 つの原子の軌道間の重なりを占める価電子を形成する結合が含まれます。
重要なことに、これらの電子は共有されていますが、以前と同じ原子軌道を占有していると考えられています。たとえば、2 つの水素原子がシグマ結合を形成する場合、結合に関与する 2 つの電子は依然として s を占有します。 水素の軌道。これは、電子が新しく形成された分子軌道を占有することを含む分子結合理論とは対照的です。
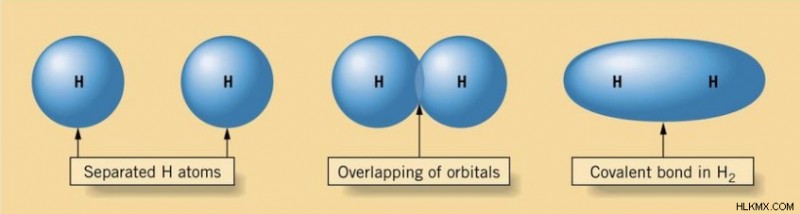
原子価結合理論における結合順序
さらに、この反結合軌道は、結合が形成されるかどうか、または結合が切れるかどうかを決定できます。結合次数式として知られるツールを使用すると、形成される結合の数を予測できます:
結合次数 =[結合軌道の電子の合計 – 反結合軌道の電子の合計]
例として、ネオンはそれ自体と結合できません。その分子軌道が満たされているため、2 つのネオン原子間の中間結合には 4 つの電子があります。シグマ結合軌道は 2 つの電子で満たされるため、残りの 2 つの電子はシグマ反結合軌道に入り、結合が形成されなくなります。
原子価結合理論におけるハイブリッド化
原子価結合理論は、六フッ化硫黄などの分子の存在をどのように説明しますか?中心原子 (硫黄) は 6 回結合する必要がありますが、孤立価電子は 2 つしかありません)。議論するには、ハイブリダイゼーションの話題を議論しなければなりません.
ハイブリダイゼーションとは、2 つ以上の原子軌道を組み合わせてまったく新しい軌道を形成し、追加の電子グループ (電子と結合の孤立電子対) を保持するプロセスです。さらに、混成軌道は相対的なエネルギー レベルの有用な指標として機能します。より多くの s 特性を持つ (p と d 混成が少ない) 混成軌道はエネルギー レベルがはるかに低く、結合軌道がより優れた電子受容体であることを意味します。
ハイブリダイゼーションがエネルギー的に好ましい理由
完全な軌道から電子をまったく含まない軌道に電子を導入することによって、軌道数が保存されることに注意することが重要です。新しく作成された軌道は、全体としてより低いエネルギー準位で追加の電子グループを可能にするため、形成することができます.
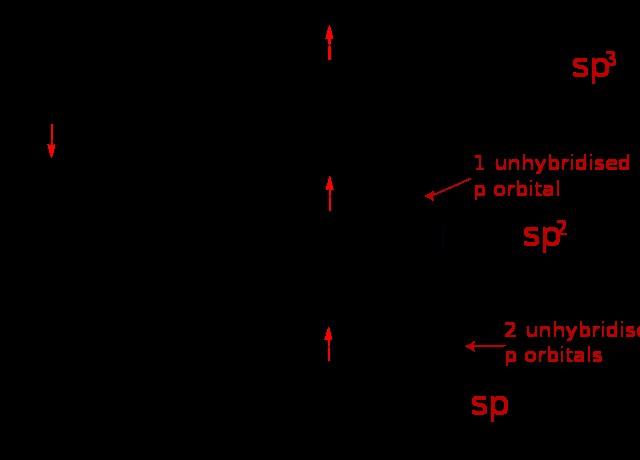
一般的に結合数必要な孤立電子対は、混成される軌道の数を示します。したがって、分子がより多くの電子グループを保持する必要がある場合、6 つの混成軌道の 1 つが形成されます。分子は、sp、sp2、sp3、sp3d、または sp3d2 のいずれかを作成します。また、満たされた p 軌道が pi 結合 (二重結合と三重結合) を形成するものであることに注意することも重要です。二重結合が存在する場合、ハイブリダイゼーションが sp2 またはそれ以上の特性であることを明確に示しています。
六フッ化硫黄に戻ると、中央の硫黄はその軌道を混成して sp3d2 混成軌道を作成します。これは、それぞれのフッ素との 6 つの結合を収容するために必要な軌道の数を満たします。ハイブリダイズに使用されない満たされた軌道は、より高いエネルギー レベルで存在し続けます。
さらに、ハイブリッド原子軌道は、VSEPR モデルの実装によって予測された形状と一致する必要があります。これは、原子価結合理論内で問題を引き起こします。 3 p 軌道と 5 d 軌道の形状は、VSEPR モデルと一致しません。それぞれが x-y、x-z、または y-z 平面のいずれかに垂直に位置する 3-p 軌道の性質を考慮に入れる場合、最初の結合の後のすべての追加結合間の角度は 90 度であると予測されます。これは VSEPR モデルでは不可能です。したがって、ハイブリダイゼーションが発生すると、新しく形成された軌道の形状は元の軌道とは異なります。
原子価結合理論におけるハイブリッド化と共鳴
共鳴構造を持つ分子を扱う場合、混成軌道は一定のままでなければなりません。したがって、分子のハイブリダイゼーションを決定する前に、まず分子のすべての可能な共鳴構造を検討します。分子内の特定の原子が 1 つの共鳴構造で二重結合を形成し、別の共鳴構造で孤立電子対を保持している場合、その混成はより高い s 特性を持つものになります。つまり、原子が 1 つの共鳴構造で sp3 のように見え、別の共鳴構造で sp2 であるように見えても、分子は両方の共鳴構造で sp2 でなければならない
原子価結合理論におけるシグマ結合とパイ結合
ハイブリダイゼーションは、原子が孤立価電子の数を超えてどのように結合を形成するかを説明できますが、二重結合と三重結合がどのように形成されるかを説明します.
まず、シグマとパイの 2 種類の結合について説明する必要があります。シグマ結合は、各原子の利用可能な最高軌道が互いに重なり合うときに形成されます。建設的な相互作用により、2 つの原子間にシグマ結合が形成され、2 つの原子核間でより高い電子密度が共有されます。
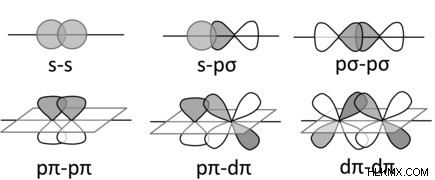
2 つの原子間の追加の結合は、パイ結合の形成で説明されています。これは、それぞれの原子のハイブリダイズしていない (満たされた) p 軌道が重なり合い、確立されたシグマ結合の外側の 2 つの原子間でより高い電子密度を形成する場合に発生します。繰り返しますが、この結合は反結合軌道も作成することに注意することも重要です。この軌道が満たされると、2 つの反応の間の結合が切れます。したがって、結論として、原子間の単結合にはシグマ結合があり、2 つの原子間の追加の結合はパイ結合です。二重結合には 1 つのシグマ結合と 1 つのパイ結合があり、三重結合には 1 つのシグマ結合と 2 つのパイ結合があります。二原子窒素のような分子を参照すると、N2 の形成には、三重結合を満たすために 2 つの窒素原子間に 1 シグマ結合と 2 パイ結合が必要です。
四重結合?
p 軌道の重なりが pi 結合を形成します。すべての原子には 3 つの p 軌道があるため、当然疑問が生じます:なぜ分子は 1 つのシグマ結合と 3 つのパイ結合を形成して四重結合を形成できないのでしょうか?
Pi 結合は、最初のシグマ結合に直交 (垂直) な p 軌道が重なり合うことによって形成されます。ただし、シグマ結合に垂直にできるのは 3 p 軌道のうち 2 つだけです。 p軌道の3番目は、特定のシグマ結合に平行です。したがって、原子は d 軌道を呼び出して四重結合を形成する必要があります。
レビューの質問:
次の復習問題を自分で試してみてください。質問を完了したら、スクロールしてページのさらに下にある回答を見つけてください。
1:エチンにはシグマ結合とパイ結合がいくつありますか?

2:H20 にはシグマ結合とパイ結合はいくつありますか?

3:フルクトースにはシグマ結合とパイ結合がいくつありますか?

4:メタンの炭素原子が形成する混成軌道は?
5:アンモニア分子の窒素原子が形成する混成軌道は?
答え:
1:エチンは 3 シグマ結合と 2 パイ結合を形成します
2:H2O は 2 つのシグマ結合を形成します。
3:フルクトースは 24 シグマ結合と 2 パイ結合を形成します。
4:メタンの炭素は、4 つの電子グループ (4 つの結合、0 の孤立電子対) を含み、共鳴構造を持たないため、sp3 混成軌道を形成します。
5:アンモニア中の窒素は、4 つの電子グループ (3 つの結合、1 つの孤立電子対) を含み、共鳴構造を持たないため、sp3 混成軌道を形成します。







