コア コンセプト
この記事では、原子番号、その定義、元素を分類する上での有用性、化学における理論としての歴史について学びます。
要素
ある要素が別の要素と異なるのは、正確には何ですか?炭素と水素と酸素が別の物質と見なされるのはなぜですか?最も基本的なレベルでのこれらの要素の違いを説明する具体的なポイントは何ですか?
答えは原子番号です。周期表を見ると、各元素には、化学者が「原子番号」と呼ぶ 1 から 118 までの固有の値があることがわかります。水素の原子番号は 1 です。炭素の原子番号は 6 です。酸素の原子番号は 8 です。
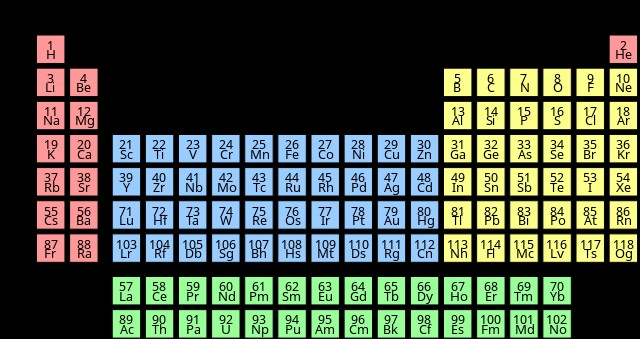
一見すると、元素の原子番号は任意であると考えるかもしれません。 1 から 118 までの原子番号にはギャップが存在しないため、原子番号は便利な数値識別としてのみ機能すると推測するのは簡単です。このような数値による識別がもたらすデータ編成の利点について考えることさえあるかもしれません。ただし、原子番号は任意ではありません。各元素の亜原子構造について基本的なことを言っています.
原子番号とは?
本質的に、要素は原子の一種です。原子自体は、化学者が亜原子粒子、すなわち陽子、電子、中性子と呼ぶもので構成される小さな丸い構造です。異なる元素には、これらの亜原子粒子の数が異なる原子が含まれます。
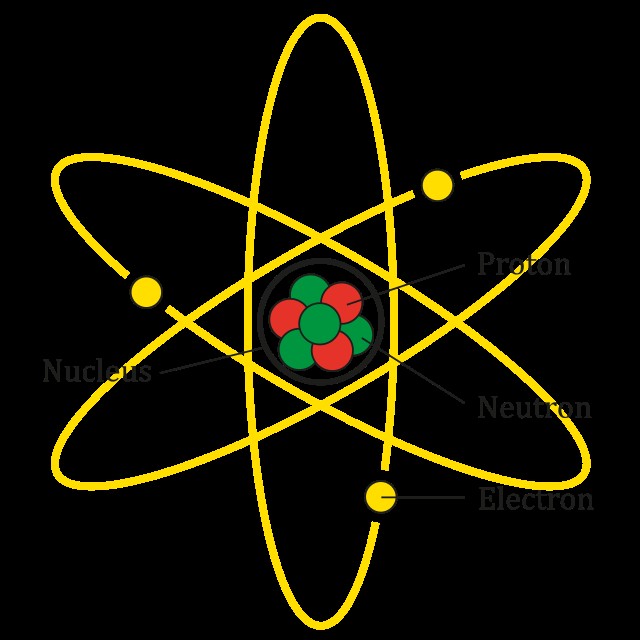
これを念頭に置いて、元素の原子番号は、元素の 1 つの原子に含まれる陽子の数を表します。したがって、水素原子には 1 つの陽子があり、炭素原子には 6 つの陽子があります。
重要なのは、化学者が原子番号を the として使用することです。 要素の特性を定義します。原子は中性子と電子をいくつでも持つことができますが、陽子が 6 個ある限り、化学者は常にそれを炭素原子と見なします。
炭素を特に念頭に置くと、その原子構造はほとんどの場合 6 個の中性子を持ちますが、化学者は 7 個、8 個、またはそれ以上の中性子を持つ他の形態の炭素について知っています。異なる中性子数、したがって異なる原子量を持つ元素の変種は、その元素の「同位体」と呼ばれます。また、酸素はその元素の形で 8 個の電子を持っていますが、特定の条件下では 10 個の電子を持つこともできます。異なる電子数、つまり異なる電荷を持つ元素のバリアントは、元素の「イオン」と呼ばれます。
原子番号と周期表
原子は陽子の数だけでなく、中性子や電子の数も異なることが知られているのに、なぜ陽子についてそんなに気にするのでしょうか?結局のところ、化学者は周期表の原子番号で元素を整理しています。これは、原子の陽子番号に関連する固有の重要性を示唆しています。その答えは、さまざまな元素の化学にあります。
実際、化学者は常に原子番号を使用して元素を分類していたわけではありません。現代の周期表の設計者であるドミトリー・メンデレーエフは、1869 年に最初の周期表を原子質量に基づいて配置しました。原子質量は基本的に陽子と中性子の合計に等しいため、原子番号と強く相関します。実際、メンデレーエフの最初の周期表は、現代の周期表と同様の順序で元素を配置しています。

原子量を使用しないものは?
しかし、表をざっと見てみると、元素を原子質量で並べるのは役に立たず、誤解を招くことがわかりました。まず、一部の元素には固有の原子質量がありません。この表が作成された時点で、化学者はニッケルとコバルトの原子質量が互いにほぼ等しいと見積もっていました。原子量が一意でないことから、この方法で元素を意味のある順序に並べることは不可能であることが示唆されました。
第二に、さらに厄介なことに、元素の化学的挙動が質量ベースの秩序化を弱体化させました。当時の化学者たちは、原子質量が非常に離れた特定の元素が同様の化学的特性を持っていることを理解していました。フッ素、塩素、臭素、およびヨウ素はそれぞれ、二原子の元素形態を持ち、排他的に -1 電荷に電離する強い傾向がありました。ナトリウム、カリウム、ルビジウム、セシウムは信じられないほど不安定な中性状態にあり、+1 の荷電イオンしか形成していないようでした。化学者はまた、炭素、ケイ素、セレン、窒素、リン、ヒ素を同様の挙動のためにグループ化しました.
化学者の眉をひそめたのは、「ハロゲン」と呼ばれるこの最初のグループの配置でした。メンデレーエフは、これらの類似した化学基が、これらのハロゲンの行を含む同じ行を共有するように、表を配置しました。しかし、彼は、テルルが元素の酸素グループと同様の化学的挙動を持っていることを知っていました.テルルはヨウ素よりも原子量が重いため、メンデレーエフは化学グループを維持するためにヨウ素の 1 つ前にテルルを紛らわしく配置せざるを得ませんでした。
メンデレーエフの最初の表が出版された直後に、表を再配置する必要があることが明らかになりました.
原子番号の力
半世紀以上にわたり、化学者は周期表に関してぎこちない空間に住んでいました。一方では、彼らは、メンデレーエフの 1869 年のテーブルには、新しいモデルを必要とする欠陥があることを理解していました。他方、より良いモデルは存在せず、原子質量表は依然としてほとんどの化学グループを維持していました.
これは、アーネスト・ラザフォードが有名な金箔実験のデータを発表した 1911 年に変わりました。ラザフォードは、それぞれの原子が反対の荷電粒子の雲の中に荷電粒子の原子核を持っていると理論付けました。重要なことに、これは科学者がこの核電荷を理論的に測定できることを意味していました。化学者はさらに、特定の元素の電荷値が原子核内の陽子と呼ばれる粒子の数に対応すると理論付けました。その後の数十年で、「原子番号」と呼ばれるそれぞれの核電荷が測定され、元素を順序付けする別の方法が提供されました。
このようにして、周期表の現代的な形が定式化されました。前の表とは異なり、原子番号で並べると、化学基の配置がより適切に維持されます。

さらに、この最新の反復により、テーブル全体のトレンドが出現します。これらの傾向は、電気陰性度、電子親和力、原子半径、およびイオン化エネルギーです。各傾向は、各元素の陽子数と直接関係があります。これにより、表の右上隅または左下隅に近づくと、各トレンドの強度が増加または減少します。これらの傾向を確認するには、インタラクティブな周期表をチェックしてください。







