主な違い – フッ素とフッ素
フッ素は、ハロゲンのグループに属する化学元素です。最軽量のハロゲンです。フッ化物は、フッ素から形成される陰イオンです。フッ素は、化合物中にフッ化物陰イオンの形で存在することがよくあります。フッ素は、地球の地殻で最も一般的な 13 番目の化学元素であることがわかっています。最も工業的に重要な鉱物は、蛍石、フッ素アパタイト、氷晶石です。フッ素とフッ化物の化学的性質を考えると、原子構造と化学的挙動に違いがあります。フッ素とフッ化物の主な違いは、電子の数です。 フッ素の電子数は 9 ですが、フッ化物の電子数は 10 です。
対象となる主な分野
1.フッ素とは
– 定義、特性、反応、応用
2.フッ化物とは
– 定義、特性、反応、応用
3.フッ素とフッ素の関係
– フッ素とフッ化物
4.フッ素とフッ化物の違いは何ですか
– 主な相違点の比較
キーワード:陰イオン、塩基、氷晶石、フッ素アパタイト、フッ化物、フッ素、蛍石、ハロゲン 
フッ素とは
フッ素は、記号 F で表される化学元素です。フッ素は元素周期表の 7 族に位置しています。したがって、フッ素は非金属が存在するpブロックに属します。 原子番号 この元素の は 9 です。電子配置は 1s2s2p として与えられます。 pサブシェルに5個の電子があるため、1つのp軌道に不対電子があります。したがって、フッ素は、(ネオンの)希ガスの電子配置を得て安定するために、1つの電子を得ると容易にアニオンを作ることができます。さらに、フッ素はこれまでに発見された中で最も電気陰性度の高い元素です。 (電気陰性度の値は 4.0 です)。
フッ素は地殻で 13 番目に豊富な化学元素であることがわかっています。標準的な温度と圧力では、フッ素は二原子ガスとして存在します。分子式 F2 で与えられる .純粋な場合、フッ素ガスは淡い黄色のガスとして現れます。特有の(刺激的な)においがあります。反応性の高いガスです。金属を非常に素早く攻撃できます。
フッ素には天然の同位体が 1 つしかありません :F 同位体。この同位体は、核内に 9 個の陽子と 10 個の中性子を持っています。磁場に対して非常に魅力的です。フッ素は鉱物の成分としてよく見られます。最も一般的で工業的に有用な鉱物には、蛍石、フッ素アパタイト、氷晶石などがあります。蛍石では、フッ素がカルシウムと結合しています。蛍石の分子式はCaF2 .他の形態のミネラルの中でもフッ素の主な供給源です。

図 1:フローライトのかけら
リアクション
- フッ素は水素ガスと爆発的に反応します。
H2(g) + F2(g) → 2HF(g)
- フッ素ガスは水と反応して HF ガスと酸素ガスを形成します。
2H2 O(l) + 2F2(g) → 4HF(g) + O2(g)
- フッ素は、-1 酸化状態という唯一の酸化状態に簡単に還元できます。したがって、フッ素はそれ自体を還元することにより、強力な酸化剤として機能します。
F2(g) + 2KClO3(aq) + H2 O(l) → 2HF(g) + KClO4(aq)
- フッ素は非常に反応性が高いため、キセノン (Xe) などの希ガスと反応することさえあります。
Xe(g) + F2(g) → XeF2(g)
電気陰性度が高いため、フッ素は極性共有結合またはイオン結合を形成します。共有結合では、フッ素は単結合しか持つことができません。
フッ素の用途には、ポリマーやプラスチックの製造、ロケット燃料、空調などが含まれます。
フッ化物とは
フッ化物は、化学元素のフッ素から形成される陰イオンです。フッ素の還元型です。フッ化物には記号 F が与えられます。電子配置 フッ化物は1s2s2pです。これは、安定した電子配置であるネオン (Ne) の電子配置に似ています。
フッ化物をこれ以上減らすことはできません。フッ化物の酸化状態は-1です。酸化状態がゼロのフッ素にのみ酸化できます。フッ化物はフッ素から形成されるため、フッ化物は負の電荷を持っています。フッ素は陽子9個と電子9個です。フッ素は、フッ素に電子が 1 つ追加されると形成されます。余分な電子の電荷を中和するのに十分な数の陽子 (正電荷) がありません。したがって、原子全体が負の電荷を帯び、陰イオンを形成します。
フッ化物という用語は、フッ化物陰イオンから構成される化合物の名前としても使用されることがあります。たとえば、フッ化ナトリウム、フッ化カルシウムなどです。一部の錯体化合物では、フッ化物は 2 つの原子 (ほとんどの場合、2 つの金属) 間の架橋配位子として機能します。多くの場合、フッ化物はイオン化合物の陰イオンとして見られます。たとえば、金属ハロゲン化物は、他のハロゲンよりもイオン性が高いです。
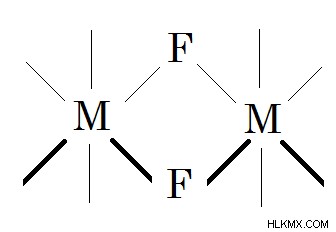
図 02:フッ化物は金属錯体の架橋配位子として機能します。上の画像で、-M- は金属原子、-F- はフッ化物です。
リアクション
フッ化物は塩基として機能します。水溶液中で、フッ化物はプロトンと結合して、弱酸であるHFを形成します。フッ化物の共役酸です。
F(aq) + H(aq) → HF(aq)
フッ化物陰イオンの塩基性は次のように与えられます。フッ化物陰イオンと水分子の反応により、HF イオンと OH イオンが形成されます。
F(aq) + H2 O(l) → HF(aq) + OH(aq)
アプリケーション
業界では、HF (フッ化水素酸) とフッ化物塩がフッ化物源として使用されています。それらは主にフルオロカーボン材料の製造に使用されます。それとは別に、生化学的アッセイでホスファターゼ活性の阻害剤として使用されました.
フッ素とフッ素の関係
フッ化物は、フッ素からできた陰イオンです。フッ化物は、フッ素の還元型です。フッ素は、主にフッ化物の形で化合物に含まれています。
フッ素とフッ化物の違い
定義
フッ素: フッ素は、記号 F で表される化学元素です。
フッ化物: フッ化物は、化学元素フッ素から形成される陰イオンです。
電荷
フッ素: フッ素は中性に帯電しています。
フッ化物: フッ化物は負に帯電しています。
電子数
フッ素: フッ素には 9 個の電子があります。
フッ化物: フッ化物には 10 個の電子があります。
電子配置
フッ素: フッ素の電子配置は1s2s2pです。
フッ化物: フッ化物の電子配置は 1s2s2p です。
酸化状態
フッ素: フッ素は酸化状態がゼロです。
フッ化物: フッ化物の酸化状態は-1です。
半径
フッ素: フッ素の原子半径は約 147 pm です。
フッ化物: フッ化物のイオン半径は約 133 pm です。
結論
フッ素はミネラルの成分として発見されています。蛍石はフッ素の主な供給源です。これがフッ素とフッ化物の違いです。フッ素は、ほとんどのフッ素含有化合物にフッ化物の形で含まれています。そうでない場合、フッ素は気相中に二原子分子として存在します。