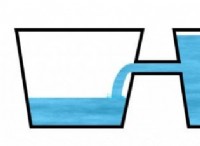
1。イオン化の程度: 完全なイオン化を受け、水中のすべての水素イオン(H+)を放出する酸は、強酸と見なされます。これらの酸は水中で完全に解離し、H+イオンの高濃度をもたらします。強酸の例には、塩酸(HCl)、硝酸(HNO3)、および硫酸(H2SO4)が含まれます。
2。解離の範囲: 解離の程度は、酸が水中のイオンに分解する程度を指します。より多くの程度に解離し、より多くのH+イオンを放出する酸は、より強い酸です。解離の程度は、しばしば酸の解離定数(KA)として表されます。 KA値が大きい酸はより広範囲に分離し、したがって強くなります。
3。水素イオンの濃度(H+): 溶液中の水素イオンの濃度が高いほど、酸が強くなります。強酸は、水に溶解すると、より高い濃度のH+イオンを生成します。この濃度は、pHスケールを使用して測定され、pH値が低いとH+イオンの酸性度が高く、濃度が高いことが示されます。
4。酸性種の性質: 酸性種の化学構造と特性もその強度に影響します。ヒドロフルオリン酸(HF)などの一部の酸は、H+イオンと陰イオン間の水素結合の形成により、酸性の強度が弱くなっています。一方、酸素(O)や塩素(CL)などの高感動性原子を含む酸は、H+イオンに及ぼすより強い引っ張りのために強くなる傾向があります。
5。温度と溶媒効果: 温度と溶媒は、酸の強度にも影響を与える可能性があります。一般に、温度の上昇は解離の増加につながり、したがって酸性度が高くなります。溶媒の選択は、酸強度にも影響を与える可能性があり、特定の溶媒はイオンをより効果的に安定化し、解離の程度に影響を与えます。
酸強度は定量的な尺度であり、pHスケールまたはKA値を使用して比較できることに注意する価値があります。酸が強いほど、pH値が低くなり、Ka値が大きくなります。