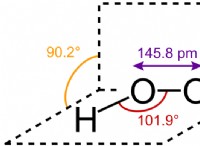
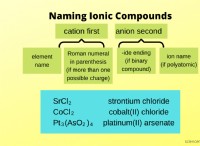
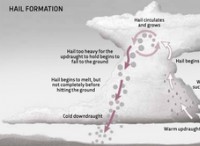
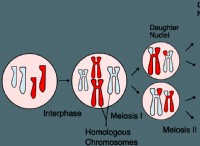
1。強酸と塩基:
- 強酸と塩基は水中で完全に解離し、それぞれすべての水素イオン(H+)および水酸化物イオン(OH-)を放出します。
- 希釈すると、H+とOHIONの両方の濃度が減少します。ただし、解離は完了しているため、H+とOHIONの相対的な割合は同じままです。したがって、強酸または塩基溶液のpHは、希釈時にほとんど変化しないままです。
2。弱酸:
- 弱酸は水中で部分的に解離し、水素イオン(H+)のごく一部を放出します。
- 希釈すると、弱酸の解離が増加します。これは、濃度の減少が平衡を産物(H+および共役ベース)にシフトするためです。
- 希釈時にH+イオンの濃度が増加すると、弱酸溶液のpHが減少します。
3。弱い基盤:
- 弱い塩基は水中で部分的に解離し、水酸化物イオン(OH-)のごく一部を放出します。
- 希釈すると、弱い塩基の解離が増加します。これは、濃度の減少が平衡を産物(OH-および共役酸)にシフトするためです。
- オハイオンの濃度が希釈時に増加すると、弱い塩基溶液のpHが増加します。
4。中性ソリューション:
- ニュートラル溶液には等濃度のH+およびOHイオンがあり、pHは7になります。
- 希釈すると、H+とOHIONの両方の濃度が減少しますが、相対的な比率は同じままです。したがって、ニュートラル溶液のpHは希釈時に変更されません。
要約すると、希釈時のpHの変化は、溶質の解離の程度に依存します。強酸と塩基はpHの最小限の変化を示し、弱酸はpHの減少を示し、弱い塩基はpHの増加を示し、中性溶液は希釈時にpHを維持します。