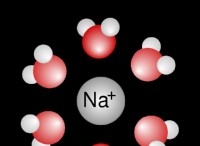
1。イオン解離:
- 水酸化ナトリウム(NaOH)は、水で完全に解離する強力な塩基であり、ナトリウム(Na+)と水酸化物(OH-)イオンを形成します。
- 塩酸(HCl)は、水中で完全に解離する強酸であり、水素(H+)と塩化物(CL-)イオンを形成します。
2。中和反応:
- 2つの溶液が混合されると、塩酸からの水素イオン(H+)は、水酸化ナトリウムから水酸化ナトリウム(H2O)から水酸化物イオン(OH-)と反応します(H2O)。
- 中和反応の全体的な化学式は次のとおりです。
naoh(aq) + hcl(aq) -> nacl(aq) + h2o(l)
3。塩化ナトリウムの形成:
- 反応が進むと、塩酸ナトリウムおよび塩化物イオン(Cl-)からの塩酸ナトリウムイオン(Na+)が塩酸ナトリウム(Cl-)を組み合わせて、中性塩である塩化ナトリウム(NaCl)を形成します。
- 塩化ナトリウムは水に溶解し、それぞれのイオンに解離します。
4。熱放出:
- 中和反応は発熱性であり、熱を放出します。放出された熱により、溶液温度が上昇し、反応混合物が触れて温かく感じることがあります。
5。 pHの変化:
- 混合する前に、水酸化ナトリウム溶液の存在により、水酸化ナトリウム溶液の存在により高いpH(塩基性)があります。塩酸は、水素イオンの存在により低いpH(酸性)です。
- 中和後、水素イオンと水酸化物イオンが同量で消費されているため、結果として得られる溶液のpHは中性(pH =7)になります。
6。塩の形成と溶液の導電率:
- 形成された塩化ナトリウム(NaCl)は、溶液の導電率を向上させます。これは、他の塩と同様に塩化ナトリウムが水中でイオンに分離し、溶液が電気を導入できるためです。
要約すると、水酸化ナトリウム溶液と塩酸を混合すると、中和反応が生じ、水と塩化ナトリウムを生成物として形成します。反応は熱を放出し、溶液のpHをニュートラルに変化させます。得られた溶液には、ナトリウムと塩化物イオンが含まれており、導電率の向上に寄与しています。