その理由は次のとおりです。
* 電解質 水に溶けたときに電気を伝達する物質です。
*この導電率は、溶液中の溶質粒子がイオンと呼ばれる帯電した種であるために発生します。 。
* イオン 電子を獲得または失った原子または分子であり、正味の正または負の電荷を与えます。
例:
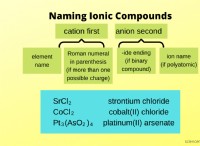
* 塩化ナトリウム(NaCl) :水に溶解すると、正に帯電したナトリウムイオン(Na+)および負に帯電した塩化物イオン(CL-)に解離します。
* 水酸化カリウム(KOH) :カリウムイオン(K+)および水酸化物イオン(OH-)に溶解します。
* 塩酸(HCl) :イオン化して、水素イオン(H+)および塩化物イオン(Cl-)を形成します。
キーテイクアウト: 溶液中のイオンの存在は、電解質が電気を導入するものです。