基本を理解する:
* 原子: 物質の基本的な構成要素。それらは、電子に囲まれた核(陽子と中性子を含む)で構成されています。
* 電子: シェルまたはエネルギーレベルで核を周回する負に帯電した粒子。
* 陽子: 核内の正に帯電した粒子。
* 中性子: 核内の中性粒子。
* イオン: 電子を獲得または失った原子で、正味の正または負の電荷をもたらします。
イオン形成の予測:
1。価電子: 重要なのは、原子の最も外側のシェルの電子の数、原子価電子と呼ばれることです。原子は、通常、最も外側のシェルに8つの電子がある安定した電子構成を実現するために電子を獲得または失う傾向があります(オクテットルール)。
2。オクテットルール: 原子は、安定性のために電子の完全な外殻を持つように努力しています。
3。定期的な傾向:
* 金属: 金属は電子を *失い、積極的に帯電したイオン(陽イオン)を形成する傾向があります。周期表の位置は、一般に、それらが失う電子の数を示しています。
* 非金属: 非金属は、電子を *獲得する傾向があり、負に帯電したイオン(アニオン)を形成します。
4。電気促進性: 原子が電子を失う傾向。 金属は非金属よりも電気依存症です。
例:
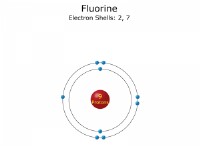
* ナトリウム(Na): ナトリウムには1つの価電子があります。この電子は、完全な外側のシェルを達成し、+1電荷でナトリウムイオン(Na +)を形成します。
* 塩素(cl): 塩素には7つの価電子があります。完全な外側シェルを達成するために1つの電子を *獲得 *し、-1電荷で塩化物イオン(Cl-)を形成します。
例外:
* 遷移金属: これらの要素は、電子構成の複雑さにより、さまざまな電荷で複数のイオンを形成できます。
* 外側のシェルが不完全な要素: 水素やヘリウムなどの一部の要素は、オクテットルールに厳密に従っていません。
考慮すべき重要な要因:
* グループ番号: 周期表のグループ番号は、多くの場合、イオンの電荷を示すことができます(遷移金属を除く)。
* 電子構成: 原子内の電子の配置を理解することは、イオンの形成を予測するために重要です。
* 電気陰性度: 原子が電子を引き付ける能力。より高い電気陰性度はアニオンの形成を支持します。
要約: イオンは、原子がその価電子電子の数、周期表の位置、および電気陰性度を考慮することにより形成される可能性が高いと予測できます。