pH指示薬または酸塩基指示薬は、pHに応じて色の変化を引き起こす溶液に少量添加される化学物質です。これは、一般的なインジケーターの料金、それらがどのように機能するかの説明、およびニーズに適したものを選択するためのヒントです.
pH指示薬の使い方
指示薬は、正確な pH または水素イオン濃度では色が変わりません。代わりに、色の変化は水素イオン濃度の範囲で発生します。弱アルカリ性で変化する指示薬で弱酸を滴定します。弱酸性pHで変色する指示薬を用いて弱塩基を滴定します。強酸または強塩基を滴定する場合は、中性 pH 付近で色の変化を示す pH 指示薬を目指してください。
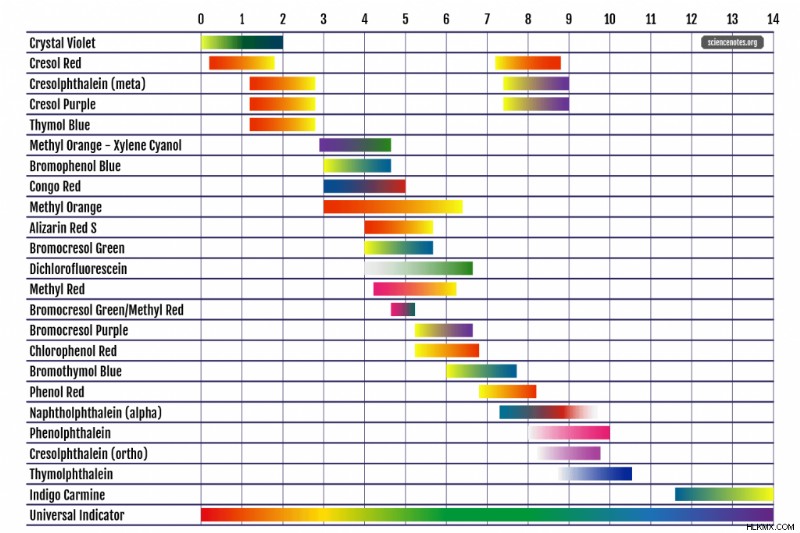
一般的な pH インジケーターの表
これは、一般的な pH 指示薬、その pH 範囲、溶液、および色の変化のチャートです。一部のインジケーターは複数の色の変化を表示するため、リストに複数回表示されます。さまざまな参考文献には、わずかに異なる pH 値と色が記載されています。これは、pH 範囲が明確に定義されておらず (1 つの pH 値以内の精度が期待される)、色が判断基準であるためです。
| 指標 | pH 範囲 | 10 ml あたりの量 | 酸 | ベース |
| チモールブルー | 1.2-2.8 | 0.1%溶液を1〜2滴。赤 | 黄 | |
| ペンタメトキシレッド | 1.2-2.3 | 1 滴 0.1% 溶液。 70% アルコール | 赤紫 | 無色 |
| トロペリン OO | 1.3-3.2 | 1滴 1% aq. | 赤 | 黄 |
| 2,4-ジニトロフェノール | 2.4-4.0 | 0.1%溶液を1〜2滴。 50% アルコール無色 | 黄 | |
| メチルイエロー | 2.9-4.0 | 1 滴 0.1% 溶液。 90% アルコール | 赤 | 黄 |
| メチルオレンジ | 3.1-4.4 | 1滴 0.1% aq. | 赤 | オレンジ |
| ブロモフェノール ブルー | 3.0-4.6 | 1滴 0.1% aq. | 黄 | 青紫 |
| テトラブロモフェノール ブルー | 3.0-4.6 | 1滴 0.1% aq. | 黄 | 青 |
| アリザリンスルホン酸ナトリウム | 3.7-5.2 | 1滴 0.1% aq. | 黄 | バイオレット |
| α-ナフチルレッド | 3.7-5.0 | 1 滴 0.1% 溶液。 70% アルコール | 赤 | 黄 |
| p -エトキシクリソイジン | 3.5-5.5 | 1滴 0.1% aq. | 赤 | 黄 |
| ブロモクレゾール グリーン | 4.0-5.6 | 1滴 0.1% aq. | 黄 | 青 |
| メチルレッド | 4.4-6.2 | 1滴 0.1% aq. | 赤 | 黄 |
| ブロモクレゾール パープル | 5.2-6.8 | 1滴 0.1% aq. | 黄 | 紫 |
| クロロフェノールレッド | 5.4-6.8 | 1滴 0.1% aq. | 黄 | 赤 |
| ブロモフェノール ブルー | 6.2-7.6 | 1滴 0.1% aq. | 黄 | 青 |
| p -ニトロフェノール | 5.0-7.0 | 1-5 滴 0.1% aq. | 無色 | 黄 |
| アゾリトミン | 5.0-8.0 | 5 滴 0.5% aq. | 赤 | 青 |
| フェノールレッド | 6.4-8.0 | 1滴 0.1% aq. | 黄 | 赤 |
| ニュートラルレッド | 6.8-8.0 | 1 滴 0.1% 溶液。 70% アルコール | 赤 | 黄 |
| ロゾリン酸 | 6.8-8.0 | 1 滴 0.1% 溶液。 90% アルコール | 黄 | 赤 |
| クレゾールレッド | 7.2-8.8 | 1滴 0.1% aq. | 黄 | 赤 |
| α-ナフトールフタレイン | 7.3-8.7 | 1-5 滴 0.1% 溶液。 70% アルコール | バラ | 緑 |
| トロペリン OOO | 7.6-8.9 | 1滴 0.1% aq. | 黄 | ローズレッド |
| チモールブルー | 8.0-9.6 | 1-5 滴 0.1% aq. | 黄 | 青 |
| フェノールフタレイン | 8.0-10.0 | 1-5 滴 0.1% 溶液。 70% アルコール | 無色 | 赤 |
| α-ナフトールベンゼイン | 9.0-11.0 | 1-5 滴 0.1% 溶液。 90% アルコール | 黄 | 青 |
| チモールフタレイン | 9.4-10.6 | 1 滴 0.1% 溶液。 90% アルコール | 無色 | 青 |
| ナイルブルー | 10.1-11.1 | 1滴 0.1% aq. | 青 | 赤 |
| アリザリンイエロー | 10.0-12.0 | 1滴 0.1% aq. | 黄 | ライラック |
| サリチルイエロー | 10.0-12.0 | 1-5 滴 0.1% 溶液。 90% アルコール | 黄 | オレンジブラウン |
| ジアゾバイオレット | 10.1-12.0 | 1滴 0.1% aq. | 黄 | バイオレット |
| トロペリン O | 11.0-13.0 | 1滴 0.1% aq. | 黄 | オレンジブラウン |
| ニトラミン | 11.0-13.0 | アルコール 70% に 0.1% のソルンを 1 ~ 2 滴落とします。 | 無色 | オレンジブラウン |
| ポワリエの青 | 11.0-13.0 | 1滴 0.1% aq. | 青 | バイオレットピンク |
| トリニトロ安息香酸 | 12.0-13.4 | 1滴 0.1% aq. | 無色 | オレンジレッド |
このリストの pH 指示薬に加えて、果物、野菜、花、ジュース、スパイスを使用して作成できる多くの天然の酸塩基指示薬があります。赤または紫のキャベツ ジュースは、これらの中で最もよく知られています。
ユニバーサル インジケーター
ユニバーサル インジケーターは、さまざまな pH 値で滑らかな色の変化を示す複数の異なる pH インジケーターの混合物です。複数の汎用指示薬の処方があるため、pH 範囲と色は処方によって異なります。最も一般的なものは、1933 年に発表された山田式のバリエーションです。典型的なレシピには、1-プロパノール、ナトリウム塩、水酸化ナトリウム、一ナトリウム塩、フェノールフタレイン、メチルレッド、ブロモチモールブルー、およびチモールブルーが含まれます。この混合物は、赤、橙黄色、緑、青、藍紫の色を表示します:
| pH 範囲 | 色 | 示す |
| <3 | レッド | 強酸性 |
| 3 ~ 6 | オレンジから黄色 | 弱酸性 |
| 7 | 緑 | ニュートラル |
| 8~11 | ブルー | 弱アルカリ性(塩基性) |
| > 11 | インディゴからバイオレット | 強アルカリ性(塩基性) |
pH インジケーターの仕組み
ほとんどの pH 指示薬は弱酸または弱塩基です。それらは一般的な化学反応に従って解離します。
HInd + H2 O ⇌ H3 O + Ind
ここで、HInd は指示薬の酸型、Ind はその共役塩基です。 HInd と Ind の比率は、溶液の色を決定し、ヘンダーソン-ハッセルバルヒの式に従って間接的に溶液の pH を示します。
pH =pK a + ログ 10 [Ind] / [HInd]
pH 指示薬の色の変化は瞬間的ではないことに注意してください。代わりに、酸と共役塩基の色が混在する pH 範囲があります。指示薬は、プラスまたはマイナス 1 の pH または pKa 値の範囲内で、適度に正確な pH 値を示します。
pH指示薬の選び方
適切な pH 指示薬を選択する上で最も重要なステップは、研究対象の化学反応の pH 範囲内で色が変化するものを選ぶことです。滴定では、理想的には当量点で色が変化する pH 指示薬を選択する必要があります。実際には、正確な pH 値で色が変わるインジケーターを見つけることはほとんど不可能であるため、わずかに高いまたは低い pH で色が変わるインジケーターを使用する必要があります。この場合、色の変化が当量点に最も近くなるまで滴定します。
たとえば、強酸を強塩基に滴定するとします。この反応の当量点は pH 値 7 です。フェノールフタレインを使用する場合、ピンク/赤色は pH 値 8.0 未満で消失すると予想されます。溶液が無色になるまで滴定します。これは、可能な限り当量点に近いためです。メチル オレンジを使用する場合、pH 6 未満のどこかで色が黄色からオレンジ色に変化し、pH 4 付近でオレンジ色から赤色に変化すると予想されます。強酸から強塩基への反応では、黄色がオレンジ色に変わり始めるまで滴定します。 .色が赤に変わるまで待つと、等価点をはるかに超えています。
目的の pH で色が変わるインジケーターを選択できる場合は、最も急激な色の変化を示すインジケーターを使用します。たとえば、ブロモフェノール ブルーと p -ニトロフェノールはどちらも中性 pH 付近で色の変化を示しますが、黄色から青色 (ブロモフェノール) への変化は、無色から黄色 (p) への変化よりも見やすくなります。 -ニトロフェノール)
物質以外の要因としては、溶媒 (アルコールまたは水)、価格、および汎用性が挙げられます。どの pH 指示薬を選択するかは、その pH 範囲、色の変化、溶媒、入手可能性、およびコストの問題です。
参考文献
- L. S. フォスター。 Gruntfest、I. J. (1937)。 「万能指標を使った実証実験」。 Journal of Chemical Education . 14 (6):274. doi:10.1021/ed014p274
- ランゲ、ノーバート A. (1952). ランゲの化学ハンドブック (第8版)。 Handbook Publishers Inc. ASIN : B000RFWWKO
- Kolthoff, I.M.;ステンガー、V. A. (1942)。 体積分析 . Interscience Publishers, Inc.、ニューヨーク。 ISBN:978-0470500507
- シュヴァルツェンバッハ、ジェロルド (1957)。 複合滴定 .ハリー・アーヴィング訳。ロンドン:Methuen &Co.
- Zumdahl, Steven S. (2009). 化学原理 (第6版)。ニューヨーク:ホートン ミフリン カンパニー。 ISBN:978-0618946907.







