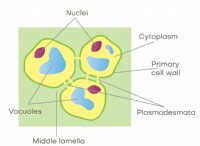
これが故障です:
* 溶解: これは、溶媒と混合された後の物質の状態を指します。
* 分子: これは、化学結合によって結合された2つ以上の原子のグループです。
* イオン: これは、1つ以上の電子を獲得または失った原子または分子であり、正味の電荷を与えます。
例:
* 塩(NaCl)水に溶ける: 塩が水に溶けると、ナトリウム(Na+)と塩化物(Cl-)イオンの間のイオン結合が壊れ、個々のイオンが水分子に囲まれます。
* 砂糖(C12H22O11)水に溶ける: 砂糖分子は極性であり、それは正と負の終わりを持っていることを意味します。砂糖が水に溶けると、極水分子は砂糖分子と水素結合を形成し、それらをバラバラにして水全体に分散させます。
溶存分子/イオンの重要な特性:
* 均一な混合物: 溶解した物質は溶媒全体に均等に分布しているため、均一な組成が生じます。
* 肉眼では見えない: 溶存分子/イオンは小さすぎて個別に見ることができません。
* 安定性: 溶液が乱れたり、溶媒が蒸発したりしない限り、溶解した物質は溶媒に分散したままです。
溶存分子/イオンの重要性:
溶解した分子とイオンは、以下を含む多くの自然および人工プロセスで重要な役割を果たします。
* 化学反応: 溶解した反応物が互いに簡単に相互作用できる溶液中に多くの化学反応が発生します。
* 生物学的プロセス: 溶存栄養素、酸素、およびその他の分子は、生物の生存に不可欠です。
* 産業プロセス: 多くの産業プロセスは、物質の溶解に依存して、望ましい製品を生産したり、化学反応を実行したりしています。
溶存分子とイオンを理解することは、化学、生物学、環境科学など、さまざまな科学分野で不可欠です。