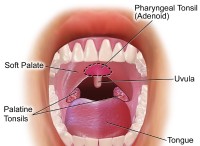
mg(s) +2agno₃(aq)→mg(no₃)₂(aq) + 2ag(s)
説明:
* 反応物:
* マグネシウム(mg): 銀白色の反応性金属。
* 硝酸銀(Agno₃): 無色の可溶性イオン化合物。
* 製品:
* 硝酸マグネシウム(mg(no₃)₂): 無色の可溶性イオン化合物。
* シルバー(Ag): 銀色の白い、反応性のある金属。
何が起こるか:
これは単一の変位反応です。 より反応性の高いマグネシウムが変位するほど、硝酸塩溶液からの反応性の低い銀が変位します。
1。マグネシウム原子は電子を失います: マグネシウムは酸化され、マグネシウムイオン(mg²⁺)を形成します。
2。銀イオンは電子を獲得します: 銀イオン(AG⁺)が減少し、固体銀(AG)原子が形成されます。
3。硝酸マグネシウムの形成: マグネシウムイオンと硝酸イオン(no₃⁻)が結合して硝酸マグネシウムを形成し、水に溶解します。
キーポイント:
*この反応は発熱です(熱を放出)。
*マグネシウムストリップに銀色の固体(銀)の形成と溶液の色の変化が観察されます。