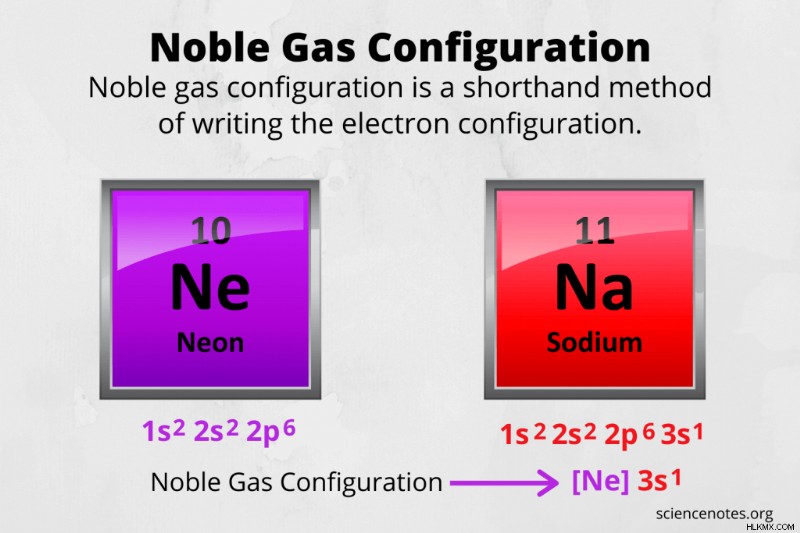
化学では、希ガス構成 は、原子の電子配置を簡単に記述する方法です。希ガス配置を使用する理由は、原子番号が大きい原子では完全な電子配置が非常に長くなるためです。
希ガス配置の書き方と、全 118 元素の電子配置のリストを以下に示します。
希ガス構成の書き方
希ガスの構成は、周期表の元素の前に発生する希ガスのコアと、原子の価電子の電子構成を示します。ただし、価電子の数を見つけるには、完全な電子配置の書き方を理解する必要があります。
希ガス構成を記述する手順は次のとおりです:
 <オール>
<オール> 各 s 殻は最大 2 個の電子を保持します。
それぞれの p 殻は最大 6 個の電子を保持します。
各 d シェルは、最大 10 個の電子を保持します。
各 f 殻は最大 14 個の電子を保持します。
1秒
2s 2p
3s 3p 3d
4s 4p 4d 4f
5s 5p 5d 5f
6s 6p 6d
7s 7p
8秒
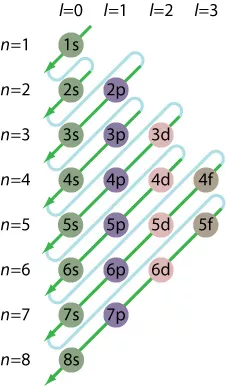
軌道が重なっていることに注意してください。つまり、シェルを順番に (1、2、3、4、…) 満たすだけではありません。代わりに、Madelung の規則を使用します。
1s <2s <2p <3s <3p <4s <3d <4p <5s <4d <5p <6s <4f <5d <6p <7s <5f <6d <7p
注:マデルングの法則は、特に一部の重い遷移金属が関係している場合、厳格な法則ではありません。相対論的効果が作用し、順序を変更します。
希ガス構成の例
たとえば、ナトリウムの希ガス配置を書きます。
- ナトリウムの原子番号は 11 であるため、中性原子には 11 個の陽子と 11 個の電子があることがわかります。
- アウフバウの原理を使用して電子殻を埋めると、1s 2s sp 3s の構成が得られます。上付き文字を合計し、電子の数が正しいことを再確認してください。
- 希ガスの構成を書きなさい。周期表を見て、ナトリウムがネオンになる前の希ガスに注意してください。ネオンの電子配置は 1s 2s 2p です。したがって、希ガス コア記号 [Ne] は、ナトリウム電子配置のその部分を置き換えます。ナトリウムの希ガス構成は [Ne] 3s です。
たとえば、ネオンの希ガス構成を書きます。
- ネオンは希ガスですが、単に [Ne] と書いて良いと言うよりも良い結果が得られます。まず、周期表を使用して、ネオン原子の電子数が 10 であることを確認します。
- アウフバウの原理に従い、電子殻を埋める:1s 2s 2p
- 周期表のネオンの前に希ガスコアを使用して希ガス配置を書き、その後に価電子を書きます。ネオンの希ガス配置は [He] 2s 2p です。ネオンの原子価は 8 (2s 殻に 2 個の電子、2p 殻に 6 個の電子) であり、これは 8 重項が満たされていることを示しています。
全 118 元素の希ガス構成のリスト
| NUMBER | 要素 | 電子構成 |
| 1 | 水素 | 1 秒 |
| 2 | ヘリウム | 1 秒 |
| 3 | リチウム | [He]2s |
| 4 | ベリリウム | [He]2s |
| 5 | ボロン | [He]2s2p |
| 6 | カーボン | [He]2s2p |
| 7 | 窒素 | [He]2s2p |
| 8 | 酸素 | [He]2s2p |
| 9 | フッ素 | [He]2s2p |
| 10 | ネオン | [He]2s2p |
| 11 | ナトリウム | [Ne]3s |
| 12 | マグネシウム | [Ne]3s |
| 13 | アルミニウム | [Ne]3s3p |
| 14 | シリコン | [Ne]3s3p |
| 15 | リン | [Ne]3s3p |
| 16 | 硫黄 | [Ne]3s3p |
| 17 | 塩素 | [Ne]3s3p |
| 18 | アルゴン | [Ne]3s3p |
| 19 | カリウム | [Ar]4s |
| 20 | カルシウム | [Ar]4s |
| 21 | スカンジウム | [Ar]3d4s |
| 22 | チタン | [Ar]3d4s |
| 23 | バナジウム | [Ar]3d4s |
| 24 | クロム | [Ar]3d4s |
| 25 | マンガン | [Ar]3d4s |
| 26 | 鉄 | [Ar]3d4s |
| 27 | コバルト | [Ar]3d4s |
| 28 | ニッケル | [Ar]3d4s |
| 29 | 銅 | [Ar]3d4s |
| 30 | 亜鉛 | [Ar]3d4s |
| 31 | ガリウム | [Ar]3d4s4p |
| 32 | ゲルマニウム | [Ar]3d4s4p |
| 33 | ヒ素 | [Ar]3d4s4p |
| 34 | セレン | [Ar]3d4s4p |
| 35 | 臭素 | [Ar]3d4s4p |
| 36 | クリプトン | [Ar]3d4s4p |
| 37 | ルビジウム | [Kr]5s |
| 38 | ストロンチウム | [Kr]5s |
| 39 | イットリウム | [Kr]4d5s |
| 40 | ジルコニウム | [Kr]4d5s |
| 41 | ニオブ | [Kr]4d5s |
| 42 | モリブデン | [Kr]4d5s |
| 43 | テクネチウム | [Kr]4d5s |
| 44 | ルテニウム | [Kr]4d5s |
| 45 | ロジウム | [Kr]4d5s |
| 46 | パラジウム | [Kr]4d |
| 47 | シルバー | [Kr]4d5s |
| 48 | カドミウム | [Kr]4d5s |
| 49 | インジウム | [Kr]4d5s5p |
| 50 | スズ | [Kr]4d5s5p |
| 51 | アンチモン | [Kr]4d5s5p |
| 52 | テルル | [Kr]4d5s5p |
| 53 | ヨウ素 | [Kr]4d5s5p |
| 54 | キセノン | [Kr]4d5s5p |
| 55 | セシウム | [Xe]6s |
| 56 | バリウム | [Xe]6s |
| 57 | ランタン | [Xe]5d6s |
| 58 | セリウム | [Xe]4f5d6s |
| 59 | プラセオジム | [Xe]4f6s |
| 60 | ネオジム | [Xe]4f6s |
| 61 | プロメチウム | [Xe]4f6s |
| 62 | サマリウム | [Xe]4f6s |
| 63 | ユーロピウム | [Xe]4f6s |
| 64 | ガドリニウム | [Xe]4f5d6s |
| 65 | テルビウム | [Xe]4f6s |
| 66 | ジスプロシウム | [Xe]4f6s |
| 67 | ホルミウム | [Xe]4f6s |
| 68 | エルビウム | [Xe]4f6s |
| 69 | ツリウム | [Xe]4f6s |
| 70 | イッテルビウム | [Xe]4f6s |
| 71 | ルテチウム | [Xe]4f5d6s |
| 72 | ハフニウム | [Xe]4f5d6s |
| 73 | タンタル | [Xe]4f5d6s |
| 74 | タングステン | [Xe]4f5d6s |
| 75 | レニウム | [Xe]4f5d6s |
| 76 | オスミウム | [Xe]4f5d6s |
| 77 | イリジウム | [Xe]4f5d6s |
| 78 | プラチナ | [Xe]4f5d6s |
| 79 | ゴールド | [Xe]4f5d6s |
| 80 | マーキュリー | [Xe]4f5d6s |
| 81 | タリウム | [Xe]4f5d6s6p |
| 82 | リード | [Xe]4f5d6s6p |
| 83 | ビスマス | [Xe]4f5d6s6p |
| 84 | ポロニウム | [Xe]4f5d6s6p |
| 85 | アスタチン | [Xe]4f5d6s6p |
| 86 | ラドン | [Xe]4f5d6s6p |
| 87 | フランシウム | [Rn]7s |
| 88 | ラジウム | [Rn]7s |
| 89 | アクチニウム | [Rn]6d7s |
| 90 | トリウム | [Rn]6d7s |
| 91 | プロタクチニウム | [Rn]5f6d7s |
| 92 | ウラン | [Rn]5f6d7s |
| 93 | ネプツニウム | [Rn]5f6d7s |
| 94 | プルトニウム | [Rn]5f7s |
| 95 | アメリシウム | [Rn]5f7s |
| 96 | キュリウム | [Rn]5f6d7s |
| 97 | バークリウム | [Rn]5f7s |
| 98 | カリフォルニア | [Rn]5f7s |
| 99 | アインスタイニウム | [Rn]5f7s |
| 100 | フェルミウム | [Rn]5f7s |
| 101 | メンデレビウム | [Rn]5f7s |
| 102 | ノーベリウム | [Rn]5f7s |
| 103 | ローレンシウム | [Rn]5f7s7p |
| 104 | ラザフォージウム | [Rn]5f6d7s |
| 105 | ドブニウム | *[Rn]5f6d7s |
| 106 | シーボーギウム | *[Rn]5f6d7s |
| 107 | ボーリウム | *[Rn]5f6d7s |
| 108 | ハッシウム | *[Rn]5f6d7s |
| 109 | マイトネリウム | *[Rn]5f6d7s |
| 110 | ダルムスタチウム | *[Rn]5f6d7s |
| 111 | レントゲニウム | *[Rn]5f6d7s |
| 112 | コペルニウム | *[Rn]5f6d7s |
| 113 | ニホニウム | *[Rn]5f6d7s7p |
| 114 | フレロビウム | *[Rn]5f6d7s7p |
| 115 | モスコビウム | *[Rn]5f6d7s7p |
| 116 | リバモリウム | *[Rn]5f6d7s7p |
| 117 | テネシン | *[Rn]5f6d7s7p |
| 118 | オガネソン | *[Rn]5f6d7s7p |
参考文献
- ジコウスキー、K.D.;ら。 (2021)。 「多電子原子の相対論的有効電荷モデル」。 Journal of Physics B:原子、分子および光学物理学 54 (11):115002. doi:10.1088/1361-6455/abdaca
- ラングミュア、アーヴィング (1919 年 6 月)。 「原子と分子における電子の配置」。 アメリカ化学会誌 . 41 (6):868–934. doi:10.1021/ja02227a002
- レイナー・キャナム、ジェフ。オーバートン、ティナ(2014)。 記述的無機化学 (第6版)。マクミラン教育. ISBN 978-1-319-15411-0.
- E.C. ストーナー (1924)。 「原子レベル間の電子の分布」。 哲学雑誌 .第6シリーズ。 48 (286):719–36. doi:10.1080/14786442408634535
- ウォン、D. パン (1979)。 「マデルングの法則の理論的正当化」. Journal of Chemical Education . 56 (11):714–18. doi:10.1021/ed056p714







