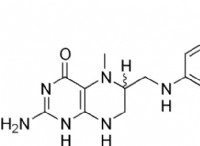
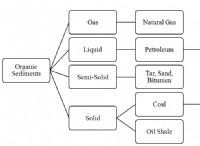
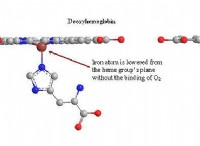
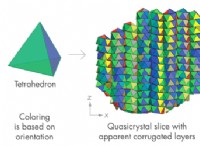
1。発熱反応:
* 一般的な傾向: 発熱反応は熱を放出するため、通常、反応中に温度が上昇します。
* 化学量論的点: 化学量論的な点では、すべての反応物が完全に消費されます。 反応する反応物はもうないので、熱生成は停止します。
* 温度変化: 温度は安定する可能性があります または、さえわずかに減少します 周囲への熱損失のため。 ただし、反応が非常に遅く、熱損失が大きくない限り、温度は大幅に低下しません。
2。吸熱反応:
* 一般的な傾向: 吸熱反応は熱を吸収するため、通常、反応中に温度が低下します。
* 化学量論的点: 化学量論的な点では、反応は完全であり、それ以上の熱は吸収されません。
* 温度変化: 温度はを安定させる可能性があります 開始温度よりも低いレベルで。
3。その他の要因:
* 反応速度: 反応が遅い場合、熱損失は有意である可能性があり、化学量論的な点の前であっても温度低下につながります。
* 熱伝達: 周囲との間での熱伝達速度は、温度の変化に影響を与える可能性があります。
* エンタルピー変化: 反応のエンタルピー変化(ΔH)は、放出または吸収される熱の量を決定します。
要約すると、化学量論的な点での温度変化は、反応の種類(発熱または吸熱)、反応速度、熱伝達、およびその他の要因に依存します。
重要な注意: 化学量論的な点での温度変化は、普遍的な現象ではありません。 この時点で温度が低下するとは限りません。