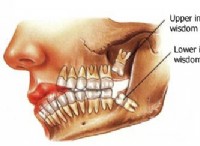
2al(s) +3cuso₄(aq)→al₂(so₄)₃(aq) + 3cu(s)
これが何が起こるかの内訳です:
* アルミニウム(al) 銅(CU)よりも反応性が高くなっています。これは、アルミニウムが電子を失う傾向が強いことを意味します。
* 銅(II)硫酸塩(Cuso₄) 可溶性塩です。つまり、水に溶けて銅(II)イオン(cu²⁺)と硫酸イオン(so₄²⁻)を形成します。
* 反応 アルミニウムがその溶液から銅を変位させる単一の変位反応です。アルミニウム原子は電子を失い、アルミニウムイオンを形成します(al³⁺)。
* 銅イオン(cu²⁺) 電子を獲得し、溶液から沈殿する固体銅(Cu)原子になります。
* 硫酸アルミニウム(al₂(so₄)₃) 可溶性塩として形成され、溶液に残ります。
簡単に言えば:
アルミホイルは銅(II)硫酸溶液と反応し、以下をもたらします。
* 固体銅の形成 アルミホイルで、赤茶色のコーティングを与えます。
* 硫酸アルミニウム 溶液に溶解します。
この反応は視覚的に観察できます:
*銅イオンが消費されるにつれて、銅(II)硫酸溶液の青い色が衰退します。
*アルミホイルは、銅の赤茶色の層でコーティングされます。