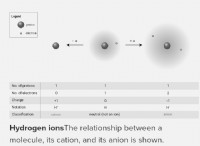
その理由は次のとおりです。
* 極性: 塩化ナトリウムはイオン化合物であり、極性溶媒に溶解することを意味します。酢酸エチルは極性溶媒です。
* "like like dislols like": この原則は、同様の極性のある物質は互いに溶解する可能性が高いと述べています。
* 分子間力: NaClのようなイオン化合物は、強力な静電力によって一緒に保持されます。 極性は、極性が弱い分子間力(双極子双極子相互作用)を持っています。これらの弱い力は、NaClの強力なイオン結合を克服するほど強力ではありません。
したがって、塩化ナトリウムは酢酸エチルに溶解しません。