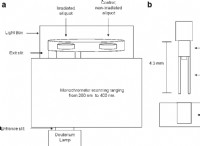
固体naCl
* 電気伝導率:非伝導
* 説明: その固体状態では、NaClは結晶格子として存在します。 ナトリウム(Na+)および塩化物(Cl-)イオンは、硬直した順序付けられた配置で保持されています。イオンは充電されますが、それらは位置に固定されており、自由に動くことはできません。イオンが移動する能力がなければ、電流の流れはありません。
溶融naCl
* 電気導電率:伝導
* 説明: NaClがその融点に加熱されると、イオン結合が分解し、イオンが可動になります。これらの自由に動くイオンは、電流を運ぶことができます。 溶融塩は電解質として機能し、イオンの動きを通じて電気を伝導します。
naCl の水溶液
* 電気導電率:伝導
* 説明: NaClが水に溶解すると、イオン結合が壊れ、Na+およびCl-イオンが水分子に囲まれます。これらの水和なイオンは、溶液全体で自由に移動し、電気の伝導を可能にします。水は溶媒として機能し、イオンの動きを促進し、電解溶液を作成します。
キーポイント:
* イオン化合物: 電気を導入するイオン化合物の能力は、イオンの可動性に依存します。
* 電解質: 自由変動イオンの存在のために電気を導く溶液は、電解質と呼ばれます。
* 溶解度: イオン化合物が溶媒(水など)に溶解する能力は、溶液中の電気伝導率にとって重要です。