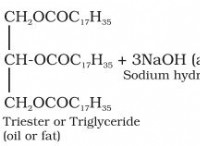1。バランスの取れた化学式を書きます:
s +cl₂→s₂cl₂
2。質量をモルに変換します:
* 硫黄:
* S =32.06 g/molのモル質量
* S =200.2 g / 32.06 g / mol =6.24 molのモル
* 塩素(Cl₂):
*cl₂=70.90 g/molのモル質量
*cl₂=100.3 g / 70.90 g / mol =1.41 molのモル
3。バランスの取れた方程式からモル比を決定します:
バランスの取れた方程式は、硫黄と塩素(Cl₂)の間の1:1モル比を示しています。これは、1モルごとに1モルごとに、完全に反応するには1モルのcl₂が必要です。
4。制限反応物を特定します:
* 硫黄: あなたは6.24モルのSを持っています
* 塩素: 1.41モルのcl₂があります。
硫黄(6.24モル)よりも塩素(1.41モル)が少ないため、塩素は制限反応物です。すべての硫黄と完全に反応するのに十分な塩素がありません。
したがって、塩素(Cl₂)は制限反応物です。