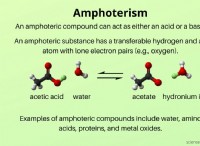
ナトリウム(Na)
* 出発点: ナトリウムには、1つの原子価(最も外側のシェルに電子)があります。
* 電子を失う: ナトリウムは、この単一の原子価電子を失い、Noble Gas Neon(完全な外側のシェルを持つ)のような安定した電子構成を達成する傾向があります。
* イオンの形成: ナトリウムがその価電子を失うと、11のプロトン(正電荷)と10電子(負電荷)のみがあるため、積極的に帯電します。この正に帯電したナトリウム原子は、ナトリウムイオン(Na+)と呼ばれます。 。
塩素(cl)
* 出発点: 塩素には7つの価電子があります。
* 電子の獲得: 塩素は、Noble Gas Argonのような安定した電子構成を実現するために、もう1つの電子を獲得したいと強く望んでいます(完全な外殻を使用)。
* イオンの形成: 塩素が電子を獲得すると、17個のプロトン(正電荷)と18個の電子(負電荷)があるため、負に帯電します。この負に帯電した塩素原子は、塩化物イオンと呼ばれます(Cl-) 。
キーポイント:
* イオン結合: ナトリウムイオンと塩化物イオンは反対の電荷を持ち、静電力を通して互いに引き付けます。この魅力はイオン結合を形成し、塩化ナトリウム(NaCl)またはテーブル塩の作成につながります。
* オクテットルール: ナトリウムと塩素の両方は、オクテットの規則に従って、この電子移動を受けることにより、外側の殻に安定した電子のオクテットを達成します。
* 電解質: ナトリウムおよび塩化物イオンは、体液に重要な役割を果たし、不可欠な電解質です。彼らは、神経衝撃、筋肉収縮、液体バランスに関与しています。
イオン結合のプロセスやその他の側面の詳細についてお知らせください!