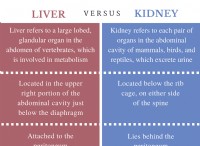
1。化学を理解する
*酢酸ナトリウム(nach₃COO)は、弱酸(酢酸、ChecoOH)の塩と強力な塩基(水酸化ナトリウム、NaOH)の塩です。
*酢酸ナトリウムが水に溶解すると、完全に解離し、ナトリウムイオン(Na⁺)および酢酸イオン(Ch₃COO⁻)に分離します。
*酢酸イオンは、平衡反応で水と反応して水酸化物イオン(OH⁻)と酢酸(Ch₃COOH)を生成し、溶液をわずかに基本的にします。
2。平衡をセットアップします
関連する平衡反応は次のとおりです。
ch₃coo⁻(aq) +h₂o(l)⇌ch₃cooh(aq) +oh⁻(aq)
3。 KB式を使用します
水酸化物イオン濃度を計算するには、酢酸イオンに塩基解離定数(KB)を使用する必要があります。
kb =[ch₃cooh] [oh⁻] / [ch₃coo⁻]
*テーブルで酢酸酸塩のKB値を見つけることができます(酢酸のKaを調べて、Kb * ka =kw関係を使用します。 アセテートのKBは約5.6x10⁻です。
4。アイステーブルをセットアップ
氷(初期、変化、平衡)テーブルを使用して、平衡濃度を決定します。
| | ch₃coo⁻| ch₃cooh|ああ|
| ----------- | ---------- | ---------- | --------- |
|初期| 0.01 m | 0 | 0 |
|変更| -x | +x | +x |
|平衡| 0.01 -x | x | x |
5。 x([oh⁻])を解く
平衡濃度をKB発現に置き換えます。
5.6 x10⁻¹⁰=(x)(x) /(0.01 -x)
KBは非常に小さいため、Xが0.01よりもはるかに小さいと仮定できるため、方程式を簡素化できます。
5.6 x 10×≈x² / 0.01
xを解く:
X²≈5.6x10⁻¹²
x≈2.37x10⁻⁶m(これは[OH⁻]です)
6。 poh を計算します
poh =-log [oh⁻] =-log(2.37 x10⁻⁶)≈5.63
7。 pHを計算します
ph + poh =14
pH =14 -POH =14-5.63≈ 8.37
したがって、酢酸ナトリウムの0.01 m溶液のpHは約8.37です。