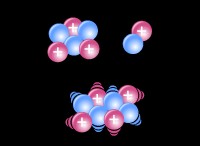
1。弱い分子間力:
*Alcl₃は、固体状態に二量体のAl₂cl₆として存在します。
*二量体構造は、比較的弱いファンデルワールスの力と双極子双極子の相互作用によってまとめられています。
*これらの弱い力は熱エネルギーによって容易に克服され、分子が固体から気相に直接移行できるようにします。
2。共有結合:
* AlCl.ダイマー内のAl-Cl結合は、強力な共有結合です。
*この強力な分子内結合は、気相の安定性に寄与し、昇華を好む。
3。極性:
*Alcl₃は、アルミニウムと塩素の電気陰性度の違いのため、極性分子です。
*分子の極性はさらに、気相に存在する傾向に寄与します。
4。低格子エネルギー:
*分子間力が弱いため、alcl₃の格子エネルギーは比較的低いです。
*この低格子エネルギーは、固体構造を分解し、気体状態に移行するために必要なエネルギーが少ないことを意味します。
5。昇華は吸熱プロセスです:
*昇華は吸熱プロセスです。つまり、熱エネルギーが発生する必要があります。
* 180°Cでは、提供された熱エネルギーは分子間力を克服し、alcl₃分子が気相に逃げるのに十分です。
要約すると、弱い分子間力、強い共有結合、極性、低格子エネルギー、および昇華性の吸熱性の組み合わせにより、塩化アルミニウムは180°Cで昇華します。