その理由は次のとおりです。
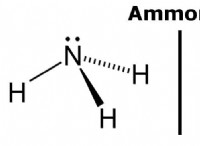
* brønsted-lowry理論: NH3は、陽子(H+)を受け入れてアンモニウムイオン(NH4+)を形成できます。ベースは陽子受容体です。
* ルイス理論: NH3には、窒素原子に孤立した電子のペアがあるため、座標共有結合を形成するために電子を寄付することができます。ルイスベースは電子ドナーです。
水中では、アンモニアは弱い塩基として作用します:
NH3(AQ) + H2O(L)⇌NH4 +(aq) + oh-(aq)
溶液中のオハイオンの存在は、アンモニアが塩基として作用したことを示しています。